题目内容
工业上生产钾的反应可以是:KCl(1)+Na(1)
NaCl(1)+K(g),对该反应能进行的上述原因,正确的解释是( )
| 850℃ |
| A、钠的活动性比钾强 |
| B、钾的沸点比钠低,但把钾蒸气抽走时使平衡向正反应方向移动 |
| C、氯化钠的热稳定性比氯化钾强 |
| D、因上述反应是可逆反应 |
考点:碱金属的性质,钠的重要化合物
专题:几种重要的金属及其化合物
分析:Na、K都是活泼金属,且K更活泼,由于K的沸点较低,抽走K蒸汽,降低了K蒸汽的浓度,有利于反应进行,以此可制备钾,以此解答该题.
解答:
解:A.钾的活动性比钠强,故A错误;
B.抽走K蒸汽,降低了K蒸汽的浓度,有利于反应进行,故B正确;
C.钠离子半径比钾离子半径小,氯化钠的热稳定性比氯化钾强,有利于生成钾,故C正确;
D.反应是否为可逆反应与能否进行无关,故D错误.
故选BC.
B.抽走K蒸汽,降低了K蒸汽的浓度,有利于反应进行,故B正确;
C.钠离子半径比钾离子半径小,氯化钠的热稳定性比氯化钾强,有利于生成钾,故C正确;
D.反应是否为可逆反应与能否进行无关,故D错误.
故选BC.
点评:本题通过工业用Na制取K的反应,考查了熵变、化学平衡的移动、置换反应等基本知识,侧重于化学与工业生产的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
下列有关中和热测定实验说法正确的是( )
| A、中和热测定实验中可以用环形铁丝搅拌棒比环形玻璃搅拌棒更方便 |
| B、中和热测定实验中若将50mL 0.50mol/L盐酸和50mL 0.55mol/L NaOH溶液改为100mL 0.50mol/L盐酸和100mL 0.55mol/L NaOH溶液,所测中和热数值将变为原实验的2倍 |
| C、教材中和热测定实验中所取NaOH的物质的量稍大于HCl,会导致所测中和热数值偏高 |
| D、做1次完整的中和热测定实验,温度计需使用3次 |
已知C5H12O(属于醇类)的同分异构体的数目8种,有关下列说法:①其与氢氯酸取代的产物是8种②能氧化成醛的结构有4种③能发生消去的结构有7种,其中说法正确的组合是( )
| A、①② | B、②③ | C、①③ | D、①②③ |
下列化学方程式或离子方程式正确的是( )
A、铁在少量氯气中燃烧:Fe+Cl2
| ||||
B、用两个铜电极电解食盐水:2Cl-+2H2O
| ||||
| C、亚硫酸钠固体溶于水:SO32-+H2O?HSO3-+OH- | ||||
| D、K37ClO3与浓盐酸(HCl)在加热时生成氯气:K37ClO3+6HCl═K37Cl+3Cl2↑+3H2O |
把80mL氢氧化钠溶液加入到120mL盐酸中,所得溶液的pH为2.如果混合前氢氧化钠溶液和盐酸的物质的量浓度相同,它们的浓度是( )
| A、1mol/L |
| B、0.05mol/L |
| C、0.1mol/L |
| D、0.5mol/L |
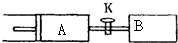 如图所示,向A、B中均充入1mol X、lmol Y,起始时A、B的体积都等于a L.在相同温度、外界压强和催化剂存在的条件下,关闭活塞K,使两容器中都发生下述反应:X(g)+Y(g)═2Z(g)+W(g)△H<0.达平衡时,A的体积为1.4a L.下列说法错误的是( )
如图所示,向A、B中均充入1mol X、lmol Y,起始时A、B的体积都等于a L.在相同温度、外界压强和催化剂存在的条件下,关闭活塞K,使两容器中都发生下述反应:X(g)+Y(g)═2Z(g)+W(g)△H<0.达平衡时,A的体积为1.4a L.下列说法错误的是( )| A、反应速率:v(B)>v(A) |
| B、A容器中X的转化率为80% |
| C、平衡时的压强:PB=PA |
| D、平衡时Y体积分数:A<B |
下列现象或事实可用同一原理解释的是( )
| A、浓硫酸和浓盐酸长期暴露在空气中浓度均降低 |
| B、氯水和双氧水均要盛装在棕色试剂瓶中 |
| C、SO2能使品红溶液和溴水均褪色 |
| D、NaCl固体中混有NH4Cl或I2,均可用加热法除去 |
 在容积固定且为2L的密闭容器中进行反应:N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol,恒温条件下,体系中某两种物质的物质的量随时间关系图,回答下列问题:
在容积固定且为2L的密闭容器中进行反应:N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol,恒温条件下,体系中某两种物质的物质的量随时间关系图,回答下列问题: