题目内容
把80mL氢氧化钠溶液加入到120mL盐酸中,所得溶液的pH为2.如果混合前氢氧化钠溶液和盐酸的物质的量浓度相同,它们的浓度是( )
| A、1mol/L |
| B、0.05mol/L |
| C、0.1mol/L |
| D、0.5mol/L |
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:设混合前氢氧化钠溶液和盐酸的物质的量浓度为c,混合液的pH=2,则反应后的溶液中氢离子浓度为0.01mol/L,然后根据氢氧化钠溶液和盐酸溶液的体积列式计算出c即可.
解答:
解:所得溶液的pH=2,则混合液中c(H+)=0.01mol/L,
设混合前氢氧化钠溶液和盐酸的物质的量浓度为c,氢氧化钠与氯化氢都是一元的强电解质,
则:
=0.01mol/L,
解得:c=0.05mol/L,
故选B.
设混合前氢氧化钠溶液和盐酸的物质的量浓度为c,氢氧化钠与氯化氢都是一元的强电解质,
则:
| (120-80)10-3L×c |
| (120+80)10-3L |
解得:c=0.05mol/L,
故选B.
点评:本题考查了酸碱混合后溶液酸碱性判断及溶液中pH的简单计算,题目难度不大,注意掌握溶液酸碱性与溶液pH的计算方法,明确溶液中氢离子浓度与溶液的pH的关系是解题关键.

练习册系列答案
相关题目
某固体化合物R不导电,但熔化或溶于水中能完全电离,下列关于R的叙述中正确的是( )
| A、R为非电解质 |
| B、R为强电解质 |
| C、R为弱电解质 |
| D、R为离子化合物 |
工业上生产钾的反应可以是:KCl(1)+Na(1)
NaCl(1)+K(g),对该反应能进行的上述原因,正确的解释是( )
| 850℃ |
| A、钠的活动性比钾强 |
| B、钾的沸点比钠低,但把钾蒸气抽走时使平衡向正反应方向移动 |
| C、氯化钠的热稳定性比氯化钾强 |
| D、因上述反应是可逆反应 |
100mL 0.1mol/L的下列溶液中,阴离子总数多少的排列顺序正确的是( )
①CaCl2 ②CH3COONa ③NaCl ④Na2CO3.
①CaCl2 ②CH3COONa ③NaCl ④Na2CO3.
| A、①>④>③>② |
| B、①>④>③=② |
| C、①>④=③=② |
| D、①>④>②>③ |
为“绿色奥运”某同学提出了下列环保建议,其中你认为可以采纳的是( )
①用气态燃料代替液态和固态燃料作为发动机动力来源;②开发生产无汞电池;③提倡使用一次性塑料餐具和塑料袋,以防传染疾病;④分类回收垃圾;⑤开发无磷洗涤剂;⑥提倡使用手帕,减少餐巾纸的使用.
①用气态燃料代替液态和固态燃料作为发动机动力来源;②开发生产无汞电池;③提倡使用一次性塑料餐具和塑料袋,以防传染疾病;④分类回收垃圾;⑤开发无磷洗涤剂;⑥提倡使用手帕,减少餐巾纸的使用.
| A、①③③④ | B、②③④⑤ |
| C、①②④⑤⑥ | D、全部 |
下列叙述正确的是( )
| A、糖类也叫碳水化合物 |
| B、凡是符合Cn(H2O)m通式的物质均可称为碳水化合物 |
| C、由于糖类的分子式可以用通式Cn(H2O)m来表示,所以在它们的分子中H和O的原子个数比一定等于2:1 |
| D、聚乙烯、葡萄糖都是高分子化合物 |
下面是生产生活中的常见有机物的分子式、结构(简)式或名称:下列有关说法正确的是( )
① ②
②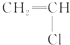 ③
③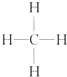 ④
④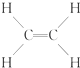 ⑤CH3CH2OH ⑥C6H12O6 ⑦CH3COOH ⑧硬脂酸甘油酯 ⑨蛋白质 ⑩聚乙烯.
⑤CH3CH2OH ⑥C6H12O6 ⑦CH3COOH ⑧硬脂酸甘油酯 ⑨蛋白质 ⑩聚乙烯.
①
 ②
②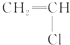 ③
③ ④
④ ⑤CH3CH2OH ⑥C6H12O6 ⑦CH3COOH ⑧硬脂酸甘油酯 ⑨蛋白质 ⑩聚乙烯.
⑤CH3CH2OH ⑥C6H12O6 ⑦CH3COOH ⑧硬脂酸甘油酯 ⑨蛋白质 ⑩聚乙烯.| A、能与溴的四氯化碳溶液发生加成反应并使之褪色的一定有①②④⑩ |
| B、投入钠一定能产生H2的是⑤⑦⑧⑨ |
| C、含碳量最高、有毒、常温下为液体且点燃时有浓的黑烟的是① |
| D、属于高分子材料的是⑧⑨⑩ |
把5molA和6molB的混合气体通入4L的密闭容器中,在一定条件下发生如下反应:5A(g)+4B(g)?6C(g)+xD(g),经过5min后反应达到平衡状态时,生成3mol C,并测得D的平均反应速率为0.1mol?L-1?min-1.下列计算结果正确的是( )
| A、x的数值是2 |
| B、A的转化率为40% |
| C、B的平衡浓度为4mol/L |
| D、反应前后混合气体的压强之比为22:23 |