题目内容
【题目】在一恒容密闭容器中,发生反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH。其平衡常数(K)和温度(T)的关系如下表:
CO(g)+H2O(g) ΔH。其平衡常数(K)和温度(T)的关系如下表:
T℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
试回答下列问题:
(1)上述反应为____(填“放热”或“吸热”)反应,升高温度,平衡向______ (填“正反应”或“逆反应”) 方向移动。
(2)某温度下,在体积为2L的恒容密闭容器中通入2molCO2(g)和4molH2(B)发生上述应,5min时反应达到平衡,测得CO2(g)的转化率是75%。
①v(H2O)=______mol·L-1·min-l。
②该温度下反应的平衡常数K=______.
(3)生产水煤气的过程如下:
①C(s)+CO2(g) ![]() 2CO(g)ΔH1
2CO(g)ΔH1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH2
CO2(g)+H2(g) ΔH2
③反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH=________ (用含ΔH1、ΔH2的代数式表示)。
CO(g)+H2O(g) ΔH=________ (用含ΔH1、ΔH2的代数式表示)。
【答案】 吸热 正反应 0.15 1.8 ΔH1+ΔH2
【解析】(1)化学平衡常数的大小只与温度有关,温度越高,化学平衡常数增大,说明化学平衡正向移动,因此正反应方向吸热,故答案为:吸热、正反应
(2)达到平衡时,CO2(g)的转化率是75%,则反应的CO2 为2![]() mol
mol
根据三段法:

①v(H2O)= ![]() mol·L-1·min-l
mol·L-1·min-l
②该温度下反应的平衡常数K=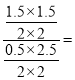 1.8
1.8
故答案为:0.15 、 1.8
(3)根据盖斯定律可得:①+②=③,所以ΔH=ΔH1+ΔH2 故答案为:ΔH1+ΔH2

 名校课堂系列答案
名校课堂系列答案【题目】用如图所示装置(X、Y是直流电源的两极)分别进行下列各组实验,则下表中各项所列对应关系均正确的一组是

选项 | X极 | 实验前U形管中液体 | 通电后现象及结论 |
A | 正极 | Na2SO4溶液 | U形管两端滴入酚酞后,a管中呈红色 |
B | 正极 | AgNO3溶液 | b管中电极反应式是4OH--4e-=O2↑+2H2O |
C | 负极 | CuCl2溶液 | b管中有气体逸出 |
D | 负极 | NaOH溶液 | 溶液PH降低 |
A. A B. B C. C D. D