题目内容
【题目】某无色溶液甲中仅含有下列离子的几种( 不考虑水的电离以及离子的水解);
阳离子 | K+、Al3+、Fe3+、Ba2+、NH4+ |
阴离子 | Cl-、CO32-、HCO3-、SO42- |
取100mL溶液甲并分成两等份进行如下实验(假设每步完全反应):
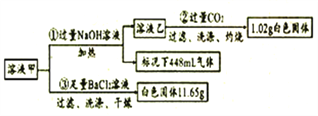
(1)由①可知,原溶液存在的离子有____,浓度为_____mol/L。
(2)写出实验②中生成沉淀的离子方程式_________。
(3)通入过量CO2充分反应后,需将反应后的混合溶液加热再过滤,其目的是_______。
(4)某同学通过分析认为该溶液中一定存在K+,其理由是________。
【答案】 NH4+ 0.4 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 防止生成氢氧化铝胶体,有利于沉淀的生成,容易分离 已知的NH4+、Al3+的正电荷总量小于SO42-负电荷总量,依据电荷守恒定律,一定有K+存在
【解析】本题主要考查离子反应。
(1)由①可知,在氢氧化钠溶液作用下产生的气体是碱性气体氨,标准状况下448mL氨的物质的量为0.02mol,原溶液存在的离子有NH4+,浓度为0.02×2/0.1mol/L=0.4mol/L。
(2)实验②中过量二氧化碳通入溶液制取氢氧化铝沉淀,同时生成碳酸氢钠,生成沉淀的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。
(3)通入过量CO2充分反应后,需将反应后的混合溶液加热再过滤,其目的是防止生成氢氧化铝胶体,有利于沉淀的生成,容易分离。
(4)某同学通过分析认为该溶液中定存在K+,其理由是已知的NH4+、Al3+的正电荷总量小于SO42-负电荷总量,依据电荷守恒定律,一定有K+存在。

练习册系列答案
相关题目