��Ŀ����
����Ŀ��TiCl4�����Ѿ�����Ҫ�ɷ�ΪTiO2���Ʊ��ѣ�Ti������Ҫ�м����Ʊ���TiCl4������ʾ��ͼ���£�
���ϣ�TiCl4�����������Ȼ��������
������ | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
�е�/�� | 58 | 136 | 181�������� | 316 | 1412 |
�۵�/�� | ��69 | 25 | 193 | 304 | 714 |
��TiCl4�е��ܽ��� | ���� | �� | �� | ���� | |
��1���Ȼ����̣�TiO2��Cl2����ֱ�ӷ�Ӧ����̼����CO��CO2��ʹ��Ӧ���Խ��У�
��֪��TiO2��s��+2Cl2��g��=TiCl4��g��+O2��g����H1=+175.4kJmol��1
2C��s��+O2��g��=2CO��g����H2=��220.9kJmol��1
�ٷ���¯�м�̼�Ȼ�����TiCl4��g����CO��g�����Ȼ�ѧ����ʽ�� ��
���Ȼ�������CO��CO2�����ת����������ͼ�жϣ�CO2����CO��Ӧ��
��H0���������������=�������ж����ݣ� ��
���Ȼ���Ӧ��β���봦�����ŷţ�β���е�HCl��Cl2�����տɵô����ᡢFeCl3��Һ����β��������Һ������ ��
���Ȼ�������ȴ�����£������˵õ���TiCl4���Һ���������к��� ��
��2�����ƹ��̣���TiCl4����������ô�TiCl4 �� ʾ��ͼ���£�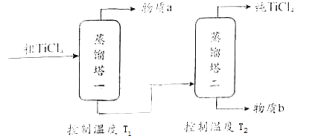
����a�� �� T2Ӧ������ ��
���𰸡�
��1��TiO2��s��+2Cl2��g��+2C��s��=TiCl4��g��+2CO��g����H=��45.5kJ?mol��1�������¶�Խ�ߣ�CO�����ʵ���Խ���CO2�����ʵ����٣�˵��CO2����CO�ķ�Ӧ�����ȷ�Ӧ������ʳ��ˮ���Ȼ�������Һ��TiO2��C
��2��SiCl4��136������
���������⣺���Ʊ���TiCl4������ʾ��ͼ���Ѿ�����������C�����Ȼ����̣���ӦΪTiO2+2Cl2+2C ![]() TiCl4+2CO����ϱ��������ݿ�֪������õ���TiCl4 �� ��1������I��TiO2��s��+2Cl2��g��=TiCl4��g��+O2��g����H1=+175.4kJmol��1
TiCl4+2CO����ϱ��������ݿ�֪������õ���TiCl4 �� ��1������I��TiO2��s��+2Cl2��g��=TiCl4��g��+O2��g����H1=+175.4kJmol��1
II.2C��s��+O2��g��=2CO��g����H2=��220.9kJmol��1 ��
��ϸ�˹���ɿ�֪��I+II�õ�TiO2��s��+2Cl2��g��+2C��s��=TiCl4��g��+2CO��g������H=��+175.4kJmol��1��+����220.9kJmol��1��=��45.5kJmol��1 ��
���Ȼ�ѧ����ʽΪTiO2��s��+2Cl2��g��+2C��s��=TiCl4��g��+2CO��g����H=��45.5kJmol��1 ��
�ʴ�Ϊ��TiO2��s��+2Cl2��g��+2C��s��=TiCl4��g��+2CO��g����H=��45.5kJmol��1��
�����¶�Խ�ߣ�CO�����ʵ���Խ���CO2�����ʵ����٣�˵��CO2����CO�ķ�Ӧ�����ȷ�Ӧ�����ԡ�H��0��
�ʴ�Ϊ�������¶�Խ�ߣ�CO�����ʵ���Խ���CO2�����ʵ����٣�˵��CO2����CO�ķ�Ӧ�����ȷ�Ӧ��
��β���е�HCl��Cl2�����տɵô����ᡢFeCl3��Һ��ʳ��ˮ����HCl���Ȼ������������������Ȼ�������β��������Һ�����DZ���ʳ��ˮ���Ȼ�������Һ��
�ʴ�Ϊ������ʳ��ˮ���Ȼ�������Һ��
���ɷ�Ӧ��֪���Ȼ�������ȴ�����£������˵õ���TiCl4���Һ���������к���TiO2��C��
�ʴ�Ϊ��TiO2��C����2����TiCl4����������ô�TiCl4 �� ��ͼ���������ݿ�֪���ȷ����SiCl4 �� ������TiCl4 �� ���ȿ����¶�T1Ϊ58������ʱ���������aΪSiCl4 �� �����¶�T2Ϊ136������ʱ�������TiCl4 �� �ʴ�Ϊ��SiCl4��136�����ң�
���Ʊ���TiCl4������ʾ��ͼ���Ѿ�����������C�����Ȼ����̣���ӦΪTiO2+2Cl2+2C ![]() TiCl4+2CO����ϱ��������ݿ�֪������õ���TiCl4 �� ��1����������е��Ȼ�ѧ����ʽ����ϸ�˹���ɿɵõ�TiO2��s��+2Cl2��g��+2C��s��=TiCl4��g��+2CO��g����H=��45.5kJmol��1��
TiCl4+2CO����ϱ��������ݿ�֪������õ���TiCl4 �� ��1����������е��Ȼ�ѧ����ʽ����ϸ�˹���ɿɵõ�TiO2��s��+2Cl2��g��+2C��s��=TiCl4��g��+2CO��g����H=��45.5kJmol��1��
���Ȼ�������CO��CO2�����ת�����¶ȸ�ʱCO�����ʵ����ࡢCO2�����ʵ����٣�
��β���е�HCl��Cl2�����տɵô����ᡢFeCl3��Һ��ʳ��ˮ����HCl���Ȼ���������������
�ܹ��˵õ���TiCl4���Һ�����ܻ��з�Ӧ���й������ʣ���2����TiCl4����������ô�TiCl4 �� ��ͼ���������ݿ�֪���ȷ����SiCl4 �� ������TiCl4 ��

 Ŀ�����ϵ�д�
Ŀ�����ϵ�д�����Ŀ������ʵ���о��к���ɫ����������Աȷ������Ľ��۲���ȷ���ǣ�������
|
|
|
�� | �� | �� |
A.�ɢ��еĺ���ɫ���壬�ƶϲ���������һ���ǻ������
B.����ɫ���岻�ܱ�������ľ̿��Ũ��������˷�Ӧ
C.�ɢ�˵��Ũ������лӷ��ԣ����ɵĺ���ɫ����Ϊ��ԭ����
D.�۵���������м���CO2 �� �ɴ�˵��ľ̿һ����Ũ���ᷢ���˷�Ӧ