题目内容
一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是( )
Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是( )
 Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是( )
Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是( )| A.若升高温度,X的体积分数增大,则正反应为吸热反 |
| B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2 |
| C.若增大压强,则物质Y的转化率减小 |
| D.以X浓度变化表示的反应速率为0.001 mol/(L·s) |
D
试题分析:反应2X(g)+Y(g)
 Z(g),升高温度,X的体积分数增大,说明反应向逆反应方向进行,故该反应的正反应为放热反应,所以A错误;将容器体积变为20 L,相当于压强变下,所以平衡向左移动,故Z的平衡浓度小于原来的1/2,故B错误;若增大压强,平衡向正反应方向进行,则物质Y的转化率增大,故C错误;以X浓度变化表示的反应速率为v(X)=2v(Z)="2" ×0.3/10/60 mol/(L·s)=" 0.001" mol/(L·s),故D正确,为本题的答案。
Z(g),升高温度,X的体积分数增大,说明反应向逆反应方向进行,故该反应的正反应为放热反应,所以A错误;将容器体积变为20 L,相当于压强变下,所以平衡向左移动,故Z的平衡浓度小于原来的1/2,故B错误;若增大压强,平衡向正反应方向进行,则物质Y的转化率增大,故C错误;以X浓度变化表示的反应速率为v(X)=2v(Z)="2" ×0.3/10/60 mol/(L·s)=" 0.001" mol/(L·s),故D正确,为本题的答案。点评:本题考查了化学平衡,化学反应速率,这些考点都是高考考查的重点和难点,本题难度中等。

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
 2NH3(g),20 min后,N2的物质的量为1.9 mol,1 h后测得容器内气体的压强不再改变,且为反应开始时压强的0.8倍,则下列叙述正确的是( )
2NH3(g),20 min后,N2的物质的量为1.9 mol,1 h后测得容器内气体的压强不再改变,且为反应开始时压强的0.8倍,则下列叙述正确的是( ) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下: 2P(g)+Q(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系:__________________________________________________________________________________。
2P(g)+Q(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系:__________________________________________________________________________________。

 (1)己知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式:______________________________________________;当温度升高时,该反应的平衡常数K值___________(填“增大”、“减小”或“不变”)。
(1)己知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式:______________________________________________;当温度升高时,该反应的平衡常数K值___________(填“增大”、“减小”或“不变”)。 2NH3,该反应在固定容积的密闭容器中进行。下列各项标志着该反应达到化学平衡状态的是____________(填序号)
2NH3,该反应在固定容积的密闭容器中进行。下列各项标志着该反应达到化学平衡状态的是____________(填序号)
 CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
CO2(g)+H2(g),CO的转化率和温度t的关系如下表: CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入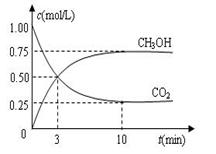

 CH3OH(g).
CH3OH(g).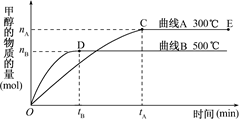
 cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答:
 2C(g)在定容密闭容器中达到平衡的标志的是:①C的生成速率与C的分解速率相等;②单位时间内amol A生成,同时生成3amolB;③A、B、C的浓度不再变化;④混合气体的总压强不再变化;⑤混合气体的平均摩尔质量不再变化;⑥用A、B、C的物质的量浓度变化表示的反应速率之比为1:3:2;⑦A、B、C的分子数目比为1:3:2;⑧混合气体的密度不再变化
2C(g)在定容密闭容器中达到平衡的标志的是:①C的生成速率与C的分解速率相等;②单位时间内amol A生成,同时生成3amolB;③A、B、C的浓度不再变化;④混合气体的总压强不再变化;⑤混合气体的平均摩尔质量不再变化;⑥用A、B、C的物质的量浓度变化表示的反应速率之比为1:3:2;⑦A、B、C的分子数目比为1:3:2;⑧混合气体的密度不再变化