题目内容
常温下,在等体积①pH=0的硫酸、②0.01mol/L NaOH溶液、③pH=10的纯碱溶液、④pH=5的NH4Cl溶液中,水电离程度的大小顺序是
| A.①>②>③>④ | B.②>①>④>③ | C.③>④>②>① | D.④>③>②>① |
C
试题分析:①pH=0的硫酸酸溶液中,OH-是水电离的,c(H+)=1mol/L,所以由水电离的c(OH-)=10-14mol/L;②0.01mol/L NaOH溶液,溶液中的H+是水电离的,c(OH-)=10-2mol/L,水电离的c(H+)=10-10mol/L;③pH=10的纯碱溶液,碳酸钠是强碱弱酸盐,水解后溶液呈碱性,溶液中的OH-是水电离出的,水电离的c(OH-)=10-4mol/L;④pH=5的NH4Cl溶液中,铵离子水解,溶液呈酸性,溶液中的H+来自水的电离,水电离的c(H+)=10-5mol/L,综合以上数据,可知水电离程度的大小顺序是:③>④>②>①,答案选C。

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目

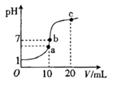

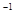 NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L