题目内容
【题目】理论上讲,任何自发的氧化还原反应都可以设计成原电池.
(1)请利用反应“Cu+2Ag+═2Ag+Cu2+”在右图方框中设计一个化学电池,指明电池的正负极材料及电解质溶液,并标出电子流动的方向. 
(2)该电池的负极反应式为;
(3)若导线上转移电子2.5mol,则正极生成银克.
(4)若原电池的总反应为Cu+2Fe3+═2Fe2++Cu2+ , 则此电池的正极反应式为 .
【答案】
(1)解:根据反应方程式知,选铜、银作电极材料,硝酸银溶液作电解质溶液,电子从负极流向正极,电子流向如图箭头所示,该装置图为: 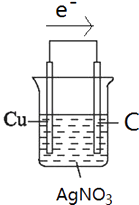
(2)Cu﹣2e﹣=Cu2+
(3)27
(4)Fe3++e﹣=Fe2+
【解析】解:(2)根据电极材料的活泼性判断正负极,较活泼的铜作负极,失去电子变成离子进入溶液,该电池的负极反应式为,所以答案是:Cu﹣2e﹣=Cu2+;(3)若导线上转移电子2.5mol,设:正极生成银质量是x,
Cu+ | 2AgNO3 | = | Cu(NO3)2 + | 2Ag | 转移电子 |
(2×108)g | 2mol | ||||
x | 2.5mol |
![]() ,解得x=27g,所以答案是:27;(4)若原电池的总反应为Cu+2Fe3+═2Fe2++Cu2+ , 此电池的正极上发生得电子的还原反应,即反应式为Fe3++e﹣=Fe2+ , 所以答案是:Fe3++e﹣=Fe2+ .
,解得x=27g,所以答案是:27;(4)若原电池的总反应为Cu+2Fe3+═2Fe2++Cu2+ , 此电池的正极上发生得电子的还原反应,即反应式为Fe3++e﹣=Fe2+ , 所以答案是:Fe3++e﹣=Fe2+ .

练习册系列答案
相关题目