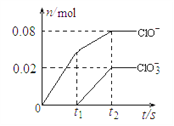
题目内容
【题目】下列反应的离子方程式书写正确的是( )
A. 氯化铝溶液中加入过量氨水:Al3++4NH3·H2O![]() AlO2-+4NH4++2H2O
AlO2-+4NH4++2H2O
B. 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-![]() CaCO3↓+H2O
CaCO3↓+H2O
C. 碳酸钙溶于醋酸:CaCO3+2H+![]() Ca2++CO2↑+H2O
Ca2++CO2↑+H2O
D. 氯化亚铁溶液中通入氯气:2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
【答案】D
【解析】试题分析:A、向氯化铝溶液中滴加过量氨水,生成Al(OH)3沉淀,错误;B、苏打的化学式为Na2CO3,澄清石灰水与少量苏打溶液混合的反应离子方程式为Ca2++CO32-=CaCO3↓,错误;C、醋酸为弱酸,应写成化学式,碳酸钙不溶于水,离子方程式中应写成化学式,错误;D、氯气具有与氧化性,与氯化亚铁反应生成氯化铁,反应离子方程式为2Fe2++Cl2=2Fe3++2Cl-,正确。

【题目】从废电池外壳中回收锌(锌皮中常有少量铁、外表沾有NH4Cl、ZnCl2、MnO2等杂 质),制取ZnSO4·7H2O可以采取如下工艺流程:

已知:①Zn(OH)2和Al(OH)3化学性质相似;②金属氢氧化物沉淀的pH:
氢氧化物 | 开始沉淀的pH | 完全沉淀的pH |
Zn(OH)2 | 5.7 | 8.0 |
Fe(OH)3 | 2.7 | 3.7 |
请回答下列问题:
(1) “酸溶”时,为了提高酸溶速率,可采取的的措施有:______________(任答一点)。
(2)“氧化”时,酸性滤液中加入NaNO2反应的离子方程式为______________。
(3) “氧化”时,为了减少污染,工业上常用H2O2替代NaNO2。
①若参加反应的NaNO2为0.2 mol,对应则至少需要加入10%H2O2溶液_______________mL(密度近似为1g·cm-3)。
②该过程中加入的H2O2需多于理论值,原因除了提高另外反应物的转化率外,还可能是_____________。
(4) “调节pH”时,若pH>8则造成锌元素沉淀率降低,其原因可能是________________。
(5)将滤渣A溶于适量稀硫酸,调节溶液pH,过滤,将滤液蒸发浓缩,冷却结晶析出ZnSO4·7H2O晶体。则该过程中需调节溶液pH的范围为_____________。
【题目】下表列出了①~⑨九种元素在周期表中的位置:
ⅠA | Ⅷ | ||||||
① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
② | ③ | ④ | ⑧ | ||||
⑤ | ⑥ | ⑦ | ⑨ | ||||
请按要求回答下列问题.
(1)化学性质最不活泼的元素的原子结构示意图为
(2)⑥④⑦的氢化物的稳定性最强的是:(写氢化物的化学式);
(3)元素③④⑤形成的离子半径由大到小的顺序是(用离子符号表示)
(4)用电子式表示元素⑤与⑦的化合物的形成过程: .