题目内容
【题目】下列反应不属于加成反应的是 ( )
A.乙烯通入溴水后,溴水褪色B.乙烯通入酸性高锰酸钾溶液后,溶液褪色
C.乙烯在一定条件下与H2反应D.乙烯在一定条件下与H2O反应
【答案】B
【解析】
A. 乙烯通入溴水中,使溴水褪色,发生加成反应生成1,2-二溴乙烷,A项正确;
B. 乙烯通入酸性高锰酸钾溶液中,使酸性高锰酸钾褪色,发生氧化反应,B项错误;
C. 乙烯在一定条件下跟H2在催化剂作用下发生加成反应生成乙烷,C项正确;
D. 乙烯在一定条件下跟水在催化剂作用下发生加成反应生成乙醇,D项正确;
答案选B。

【题目】控制变量法是化学实验的一种常用方法.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
序号 | 硫酸的体积/mL | 锌的质量/g | 锌的性状 | 温度/ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m4 |
6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
(1)化学反应速率本质上是由决定的,但外界条件也会影响反应速率的大小.本实验中实验2和实验3表明对反应速率有影响.
(2)我们最好选取实验(填3个实验序号)研究锌的形状对反应速率的影响.我们发现在其它条件相同时,反应物间的反应速率越快.
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快.原因是 .
(4)利用表中数据,可以求得:硫酸的物质的量浓度是mol/L.
【题目】25℃时,几种弱酸的电离平衡常数如下:
弱酸 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)CH3COOH、H2CO3、H2SO3三种酸中酸性最弱的是__________(填化学式)。
(2)CH3COOH的电离平衡常数表达式为K=__________。
(3)写出H2CO3的第二步电离方程式:_____________。
(4)写出H2SO3溶液和CH3COONa溶液反应的离子方程式:____________________。
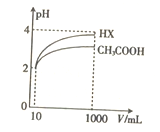
(5)将体积均为10mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH的变化如图所示,则HX的电离平衡常数____________(填“大于”“ 小于”或“等于”)醋酸的电离平衡常数,理由是__________________。