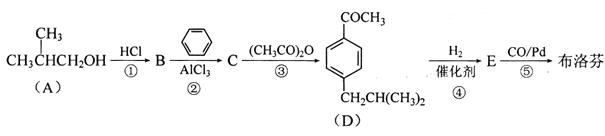
题目内容
【题目】硫代硫酸钠(Na2S2O3)商品名“海波”,俗名“大苏打”,分析化学上常用于 滴定实验。某化学兴趣小组在实验室制备硫代硫酸钠晶体并探究其化学性质。

I.制备 Na2S2O3
(1)如图,关闭K1打开K2, 反应开始后,装置c中的产物除 了 Na2S2O3外还有一种无色无味 的气体,这种气体是______。
(2)装置c中反应结束后, 先关闭分液漏斗旋塞,在e处连 接盛NaOH溶液的注射器,再关闭K2打开K1 ,其目的是_______________。待c中溶液冷却后,倒入蒸发皿,通过加热蒸发、冷却结晶和干燥等操作获得Na2S2O3 CH2O晶体。
(3)实验结束后,装置d中的溶质可能有__________________。
探究Na2S2O3的部分化学性质
【分析推理】Na2S2O3可以看成是一个S原子取代了 Na2SO4中一个O原子形成的。据此 推测,下列说法正确的是____________。
A.![]() 和
和![]() 都是正四面体结构 B.
都是正四面体结构 B.![]() 中硫硫键的键长大于硫氧键
中硫硫键的键长大于硫氧键
C.![]() 中的键角均为
中的键角均为![]() D.
D.![]() 中所有原子都满足8电子结构
中所有原子都满足8电子结构
【提出假设】①Na2S2O3与Na2SO4结构相似,化学性质也应该相似,因此室温时Na2S2O3 溶液pH=7。②从S元素的化合价推测Na2S2O3具有较强的还原性。
【验证假设】配制适量Na2S2O3溶液,进行如下实验(请填空):
实验操作 | 实验现象 | 现象解释(用离子方程式表示) | |
① | ___________________ | 溶液pH=8 | ___________ |
② | 向新制氯水中滴入适量Na2S2O3溶液 | 氯水褪色 | _____________ |
【实验结论】__________________
【答案】 CO2(或二氧化碳) 吸收a、b装置中残余的SO2,防止拆除装置时污染空气 Na2SO3、Na2CO3、Na2SO4 BC 用玻璃棒蘸取Na2S2O3溶液点在pH试纸中部,将试纸颜色与标准比色卡对照(或用pH计测Na2S2O3溶液的pH) S2O![]() +H2O
+H2O![]() HS2O
HS2O![]() +OH- S2O
+OH- S2O![]() +4Cl2+5H2O==2SO
+4Cl2+5H2O==2SO![]() +8Cl-+10H+ Na2S2O3溶液呈碱性,并具有还原性
+8Cl-+10H+ Na2S2O3溶液呈碱性,并具有还原性
【解析】a中反应:Na2SO3+H2SO4=Na2SO4+SO2+H2O,c中的反应:2Na2S +Na2CO3+4SO2 = 3 Na2S2O3+CO2,d中吸收尾气,SO2+2NaOH=Na2SO3+H2O,CO2+2NaOH=Na2CO3+H2O,2Na2SO3+O2=2Na2SO4。
(1)根据c中的反应:2Na2S +Na2CO3+4SO2 = 3 Na2S2O3+CO2,无色无味 的气体是CO2;(2)在e处连 接盛NaOH溶液的注射器,再关闭K2打开K1 ,其目的是吸收a、b装置中残余的SO2,防止拆除装置时污染空气;(3)d中吸收尾气,SO2+2NaOH=Na2SO3+H2O,CO2+2NaOH=Na2CO3+H2O,2Na2SO3+O2=2Na2SO4,实验结束后,装置d中的溶质Na2SO3、Na2CO3、Na2SO4 ;关于Na2S2O3的说法:A、S2O32―中心原子S的杂化方式是SP3,是四面体构型,但不是正四面体,故A错误;B、硫原子半径大于氧原子,S2O32―中硫硫键的键长大于硫氧键,故B正确;C、SO42―是正四面体结构,SO42―中的键角均为![]() ,故C正确;D、Na2S2O3的中心原子硫形成了4个σ键,2个π键,共12个电子,故D错误;故选BC。配制适量Na2S2O3溶液,进行如下实验,①是测溶液的PH,操作为:用玻璃棒蘸取Na2S2O3溶液点在pH试纸中部,将试纸颜色与标准比色卡对照(或用pH计测Na2S2O3溶液的pH),测定结果PH=8,说明溶液呈碱性,Na2S2O3是强碱弱酸盐,发生了水解: S2O
,故C正确;D、Na2S2O3的中心原子硫形成了4个σ键,2个π键,共12个电子,故D错误;故选BC。配制适量Na2S2O3溶液,进行如下实验,①是测溶液的PH,操作为:用玻璃棒蘸取Na2S2O3溶液点在pH试纸中部,将试纸颜色与标准比色卡对照(或用pH计测Na2S2O3溶液的pH),测定结果PH=8,说明溶液呈碱性,Na2S2O3是强碱弱酸盐,发生了水解: S2O![]() +H2O
+H2O![]() HS2O
HS2O![]() +OH- ;②向新制氯水中滴入适量Na2S2O3溶液,氯水褪色,说明Na2S2O3具有还原性,S2O
+OH- ;②向新制氯水中滴入适量Na2S2O3溶液,氯水褪色,说明Na2S2O3具有还原性,S2O![]() +4Cl2+5H2O==2SO
+4Cl2+5H2O==2SO![]() +8Cl-+10H+ ;由以上实验得出:Na2S2O3
+8Cl-+10H+ ;由以上实验得出:Na2S2O3