题目内容
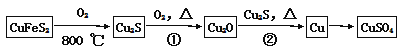
【题目】目前半导体生产展开了一场“铜芯片”革命——在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:
(1)基态硫原子的外围电子排布式为 ,硫元素与氧元素相比,第一电离能较大的元素是 (填元素符号)。
(2)反应①、②中均生成有相同的气体分子,该分子的中心原子杂化类型是 ,其立体结构是 。
(3)某学生用硫酸铜溶液与氨水做了一组实验:CuSO4溶液![]() 蓝色沉淀
蓝色沉淀![]() 沉淀溶解,得到深蓝色透明溶液,写出蓝色沉淀溶于氨水的离子方程式 ;深蓝色透明溶液中的阳离子(不考虑H+)内存在的全部化学键类型有 。
沉淀溶解,得到深蓝色透明溶液,写出蓝色沉淀溶于氨水的离子方程式 ;深蓝色透明溶液中的阳离子(不考虑H+)内存在的全部化学键类型有 。
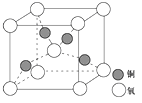
(4)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途,铜晶体中铜原子堆积模型为 ;铜的某种氧化物晶胞结构如图所示,若该晶体的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞中铜原子与氧原子之间的距离为 pm(用含d和NA的式子表示)。
【答案】(1) 1s22s22p63s23p4 ;O;(2)sp2;V型;
(3)Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O;共价键、配位键;
(4)面心立方最密堆积;![]()
![]() ×1010。
×1010。
【解析】试题分析:(1)S位于第三周期ⅥB族,是16号元素,基态硫原子的外围电子排布式为1s22s22p63s23p4;同主族元素第一电离能自上而下逐渐减小,所以第一电离能较大的是氧;故答案为:1s22s22p63s23p4;O;
(2)由(1)分析知反应①②生成的相同气体分子是SO2,SO2中价层电子对个数=2+![]() (6-2×2)=3,所以S原子采用sp2杂化,由于含有一个孤电子对,其空间构型是V型;故答案为:sp2;V型;
(6-2×2)=3,所以S原子采用sp2杂化,由于含有一个孤电子对,其空间构型是V型;故答案为:sp2;V型;
(3)硫酸铜溶液与氨水生成氢氧化铜蓝色沉淀,氢氧化铜溶于过量的氨水,形成[Cu(NH3)4]2+离子,蓝色沉淀溶于氨水的离子方程式为Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O,深蓝色透明溶液中的阳离子(不考虑H+)内存在的全部化学键类型有共价键、配位键,故答案为:Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O;共价键、配位键;
(4)铜晶体中铜原子堆积模型为面心立方最密堆积,在铜的某种氧化物晶胞中,O原子在晶胞的顶点和体心,故O原子数=![]() ×8+1=2,Cu原子全部在体心,故Cu原子数=4,即一个氧化亚铜晶胞中有2个O原子和4个Cu原子,根据密度计算公式ρ=
×8+1=2,Cu原子全部在体心,故Cu原子数=4,即一个氧化亚铜晶胞中有2个O原子和4个Cu原子,根据密度计算公式ρ=![]() 可知,体积V=
可知,体积V=![]() =
=![]() cm3,所以晶胞的边长为
cm3,所以晶胞的边长为![]() cm,根据晶胞的结构图可知,晶胞中铜原子与氧原子之间的距离晶胞边长的
cm,根据晶胞的结构图可知,晶胞中铜原子与氧原子之间的距离晶胞边长的![]() ,所以该晶胞中铜原子与氧原子之间的距离为
,所以该晶胞中铜原子与氧原子之间的距离为![]() ×
×![]() cm=
cm=![]() ×
×![]() ×1010pm,故答案为:面心立方最密堆积;
×1010pm,故答案为:面心立方最密堆积;![]() ×
×![]() ×1010
×1010

【题目】镁、铜等金属离子是人体内多种酶的辅因子。
(1)Cu位于元素周期表第四周期,铜原子核外电子有____种不同的运动状态,Cu+的核外电子排布式为________。
(2)下图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴、阳离子个数比为______。

(3)Mg是第三周期元素,该周期部分元素氟化物的熔点下表:
氟化物 | NaF | MgF2 | SiF4 |
熔点/K | 1266 | 1534 | 183 |
解释表中氟化物熔点差异的原因:___________________________。
【题目】如图所示,密闭筒形容器中,有活塞位于距全长一端1/5处,左边为空气,右边为H2、O2混合气体,标准状况下,若将H2、O2混合气体点燃引爆,活塞先左弹,恢复到原来温度后,活塞右滑停留在筒的中央,则原来H2、O2的物质的量比可能为 ( )
空气 | H2、O2的混合气 |
A. 7:1 B. 1:1 C. 1:3 D. 4:1