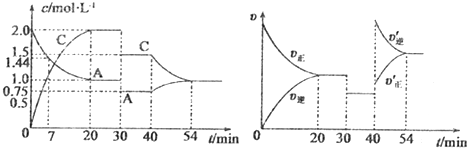
题目内容
1.硫酸钠是一种重要的化工原料,其溶解度曲线如图所示.下列说法正确的是( )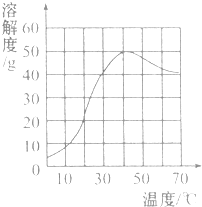
| A. | 硫酸钠的溶解度随温度升高而增大 | |
| B. | 30℃时硫酸钠饱和溶液的质量分数为40% | |
| C. | 40℃时硫酸钠的溶解度约为50g | |
| D. | 60℃时硫酸钠饱和溶液降温后一定饱和 |
分析 A、根据硫酸钠的溶解度曲线得知:温度从0°升高到40°溶解度增大,再升高温度,溶解度降低;
B、饱和溶液的溶质质量分数=$\frac{溶解度}{100g+溶解度}$×100%进行计算即可;
C、根据图象得知此温度下的溶解度即可;
D、根据降温后溶解度随温度的变化趋势分析即可.
解答 解:A、依据溶解度曲线得知:温度从0°升高到40°溶解度增大,再升高温度,溶解度降低,故A错误;
B、30℃时硫酸钠的溶解度是40g,所以此时质量分数为:$\frac{40g}{40g+100g}$×100%=28.6%,故B错误;
C、从40℃向上作垂线,可知硫酸钠的溶解度为50g,故C正确;
D、50℃时硫酸钠饱和溶液降温后是溶解度变大了,这时不会析出晶体,而会变为不饱和溶液,故D错误,
故选C.
点评 本题主要考查的是溶解度曲线,解答本题的关键是要根据物质的溶解度曲线变化情况分析问题,不能依靠原来学过的内容解决,难度不大.

练习册系列答案
相关题目
11.常温下,NC13是一种油状液体,其分子空间构型为三角锥形,下列对NC13的有关叙述错误的是( )
| A. | NC13中N-C1键键长比CCl4中C-C1键键长短 | |
| B. | NC13分子中的所有原子均达到8电子稳定结构 | |
| C. | NCl3分子是极性分子 | |
| D. | NBr3的沸点比NCl3的沸点低 |
9.有机物C5H10Cl2的结构中只含有一个甲基的同分异构体有几种(不考虑立体异构)( )
| A. | 4 | B. | 6 | C. | 10 | D. | 18 |
16.下列关于金属的说法中,正确的是( )
| A. | 篮球架的表面喷涂油漆,主要是为了美观 | |
| B. | 回收金属饮料罐,只是为了减少环境污染 | |
| C. | 银的导电性比铜好,所以常用银作电线而不用铜 | |
| D. | 不锈钢抗腐蚀性好,常用于制医疗器械、炊具等 |
13.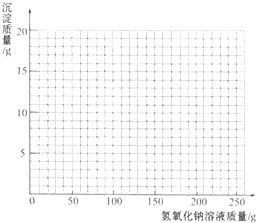 烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8g.某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入l0%的NaOH溶液,得到沉淀的质量记录如下:
烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8g.某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入l0%的NaOH溶液,得到沉淀的质量记录如下:
(1)得到沉淀的总质量为9.8g,该混合溶液中硫酸铜的质量为16g.
(2)参加反应的NaOH溶液的总质量是多少克?
(3)画出在该混合溶液中加入NaOH溶液质量与生成沉淀质量变化关系的曲线.
 烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8g.某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入l0%的NaOH溶液,得到沉淀的质量记录如下:
烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8g.某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入l0%的NaOH溶液,得到沉淀的质量记录如下:| 加入NaOH溶液的质量/g | 50.0 | 100.0 | 150.0 | 200.0 | 250.0 |
| 生成沉淀的质量/g | 0.0 | 2.5 | 8.6 | 9.8 | 9.8 |
(2)参加反应的NaOH溶液的总质量是多少克?
(3)画出在该混合溶液中加入NaOH溶液质量与生成沉淀质量变化关系的曲线.
10.用NaOH固体配制一定物质的量浓度的NaOH溶液时,不需要使用的玻璃仪器是( )
| A. | 玻璃棒 | B. | 容量瓶 | C. | 圆底烧瓶 | D. | 胶头滴管 |
11. 日本一家公司日前宣布,他们已经开发并计划大量生产一种颠覆性的阳极和阴极都是碳材料的双碳性电池(放电原理示意如图所示),充电速度比普通的锂离子电池快20倍.放电时,正极反应Cn(PF6)+e-═PF6-+nC,负极反应LiCn-e-═Li++nC下列有关说法中正确的是( )
日本一家公司日前宣布,他们已经开发并计划大量生产一种颠覆性的阳极和阴极都是碳材料的双碳性电池(放电原理示意如图所示),充电速度比普通的锂离子电池快20倍.放电时,正极反应Cn(PF6)+e-═PF6-+nC,负极反应LiCn-e-═Li++nC下列有关说法中正确的是( )
 日本一家公司日前宣布,他们已经开发并计划大量生产一种颠覆性的阳极和阴极都是碳材料的双碳性电池(放电原理示意如图所示),充电速度比普通的锂离子电池快20倍.放电时,正极反应Cn(PF6)+e-═PF6-+nC,负极反应LiCn-e-═Li++nC下列有关说法中正确的是( )
日本一家公司日前宣布,他们已经开发并计划大量生产一种颠覆性的阳极和阴极都是碳材料的双碳性电池(放电原理示意如图所示),充电速度比普通的锂离子电池快20倍.放电时,正极反应Cn(PF6)+e-═PF6-+nC,负极反应LiCn-e-═Li++nC下列有关说法中正确的是( )| A. | a极为电池的负极 | |
| B. | A-为OH- | |
| C. | 电池充电时阴极反应为:LiCn+e-═Li++nC | |
| D. | 充电时,溶液中A-从b极向a极迁移 |