题目内容
6.在联欢会上,有“魔术师”称号的陈亮同学表演了一组化学魔术:将两种无色溶液分别加入A、B两只玻璃杯中,各倒入碳酸钠溶液,观察到下列现象:A杯变为“汽水”(产生大量气泡);B杯变为“牛奶”(出现白色浑浊).请你帮助他揭开魔术秘密:(1)A杯中产生的气体是CO2.
(2)B杯中可能发生反应的化学方程式是Na2CO3+Ca(OH)2═CaCO3↓+2NaOH (任写一个).
分析 A杯变为“汽水”(产生大量气泡),则说明A中物质反应能生成气体,B杯变为牛奶,则是物质间反应生成白色沉淀.
解答 解:(1)A中加入碳酸钠能产生气体,则碳酸钠能与酸反应生成二氧化碳,故答案为:CO2;
(2)B中加入碳酸钠反应生成白色沉淀,则可能是碳酸钠与氢氧化钙反应生成了碳酸钙白色沉淀,反应为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,
故答案为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
点评 本题考查了碳酸钠的性质,完成此题,可以依据已有的知识解答,要求同学们加强对物质反应的实验现象的识记,以便灵活应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列属于混合物的是( )
| A. | 葡萄糖 | B. | 金刚石 | C. | 冰红茶 | D. | 苛性钠 |
1.硫酸钠是一种重要的化工原料,其溶解度曲线如图所示.下列说法正确的是( )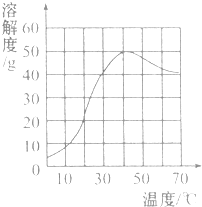

| A. | 硫酸钠的溶解度随温度升高而增大 | |
| B. | 30℃时硫酸钠饱和溶液的质量分数为40% | |
| C. | 40℃时硫酸钠的溶解度约为50g | |
| D. | 60℃时硫酸钠饱和溶液降温后一定饱和 |
18.材料是人类赖以生存和发展的重要物质基础,有机玻璃(聚甲基丙烯酸甲酯)实际上不是硅酸盐材料,而是一种( )
| A. | 橡胶 | B. | 纤维 | C. | 塑料 | D. | 玻璃 |
15.下列离子方程式正确的是( )
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 稀硫酸与氢氧化钡溶液反应:H++OH-═H2O | |
| C. | 铁与氯化铁溶液反应:Fe+Fe3+═2Fe2+ | |
| D. | 铝与氢氧化钠溶液反应:2Al+2OH-+2H2O═2A1O2-+3H2↑ |
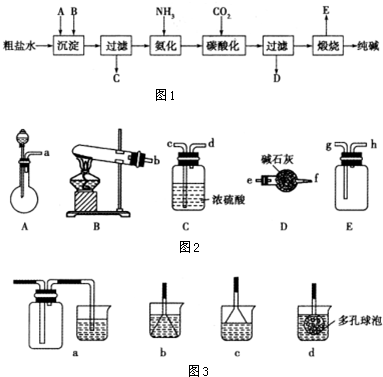
 )是一种重要的工业塑化剂,其合成路线很多,如图就是其中的一种合成方法:
)是一种重要的工业塑化剂,其合成路线很多,如图就是其中的一种合成方法: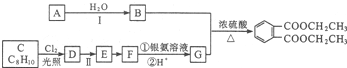
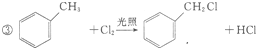
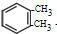 +2Cl2
+2Cl2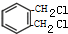 +2HCl.
+2HCl.