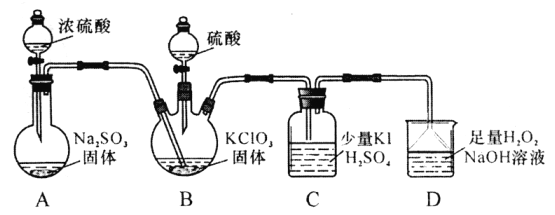
题目内容
【题目】以有机物A(含有苯环的烃,化学式C8H8)和CCl4为原料合成苯丙氨酸E的流程如下:

已知:烃分子中的氢原子被卤素原子取代所生成的衍生物叫做卤代烃,如CH3CH2Cl;卤代烃在NaOH水溶液加热条件下会水解,如:
CH3CH2Cl+NaOH![]() CH3CH2OH+NaCl
CH3CH2OH+NaCl
CH2ClCH2Cl+2NaOH![]() CH2OHCH2OH+2NaCl
CH2OHCH2OH+2NaCl
 (该反应不需要条件就迅速转化)
(该反应不需要条件就迅速转化)
R-CH2CH2OH![]() R-CH=CH2+H2O
R-CH=CH2+H2O
(1)D→E的反应类型为_____________________。
(2)A的结构简式为________________________。
(3)有关D的叙述错误的是___________(填序号)。
a.能使酸性KMnO4溶液褪色 b.能与溴的CCl4溶液反应
c.能与甲醇发生酯化反应 d.能发生水解反应
(4)C→D反应的化学方程式为___________________________________。
(5)满足下列条件的E的同分异构体共有_________种。
①属于酯类;②苯环上只有两个对位取代基,其中一个为—NH2。
【答案】加成反应 ![]() d
d 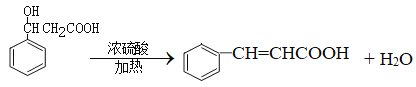 6
6
【解析】
根据B结构简式知,A为![]() ,A发生加成反应生成B,B发生水解反应然后酸化得到C,结合题给信息知C结构简式为
,A发生加成反应生成B,B发生水解反应然后酸化得到C,结合题给信息知C结构简式为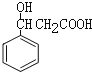 ,C发生消去反应生成D,D发生加成反应生成E,据此分析解答。
,C发生消去反应生成D,D发生加成反应生成E,据此分析解答。
(1)根据D的结构简式可知,D分子中含有碳碳双键,与氨气发生加成反应生成E;
(2)通过以上分析知A的结构简式为![]() ;
;
(3)D分子中含有羧基、碳碳双键和苯环,则
a.含有碳碳双键,所以能被酸性高锰酸钾溶液氧化而使酸性KMnO4溶液褪色,a正确;
b.含有碳碳双键,所以能与溴的CCl4溶液反应而使溴的四氯化碳溶液褪色,b正确;
c.含有羧基,所以能与甲醇发生酯化反应,c正确;
d.不含卤原子或酯基,所以不能发生水解反应,d错误;
答案选d;
(4)C发生消去反应生成D,反应的化学方程式为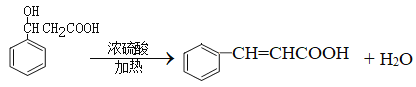 ;
;
(5)E的同分异构体符合下列条件:①属于酯类,说明含有酯基;②苯环上有两个对位取代基,其中一个为-NH2,则另一个为烃基,如果含有-NH2、-CH2CH2CH3取代基,则有邻间对三种结构;如果含有-NH2、-CH(CH3)2取代基,也有邻间对三种结构,所以符合条件的有6种结构。