题目内容
【题目】磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2在活性炭作用下反应制取少量的SO2Cl2,装置如图所示(部分夹持装置省略)。已知SO2Cl2的熔点为-54.1 ℃,沸点为69.1 ℃,遇水能发生剧烈的水解反应,并产生白雾。

(1)仪器B的名称为_____,由仪器B的使用可知SO2与Cl2反应的ΔH____(填“>”或“<”)0。
(2)仪器C的作用是________________________________。
(3)试剂X、Y的组合最适宜的是______。
a.18.4mol/LH2SO4溶液+Cu b.4mol/LHNO3溶液+Na2SO3 c.75%H2SO4溶液+K2SO3
(4)反应结束后,将丙中产物分离的实验操作的名称是______。
(5)分离产物后,向获得的SO2Cl2中加入足量NaOH溶液,振荡、静置得到无色溶液w。
①写出该反应的离子方程式:___________。
②检验溶液w中存在SO42-的方法是________。
(6)若反应中消耗的氯气的体积为896 mL(已转化为标准状况,SO2足量),最后得到纯净的磺酰氯3.3 g,则磺酰氯的产率为_________(保留三位有效数字)。
【答案】球形冷凝管 < 吸收尾气Cl2、SO2防止污染环境,同时防止空气中的水蒸气进入反应体系,引起磺酰氯水解 c 蒸馏 SO2Cl2+4OH-=SO42-+2Cl-+2H2O 取少量w溶液于试管中,加入BaCl2溶液,有白色沉淀生成,则溶液w中存在SO42- 61.1%
【解析】
甲装置制备二氧化硫,己装置制备氯气,二氧化硫与氯气在丙中反应生成SO2Cl2,丙中活性炭可能起催化剂作用,SO2Cl2遇水发生剧烈的水解反应,乙为干燥二氧化硫,戊是饱和食盐水,降低氯气溶解度,丁干燥氯气,SO2Cl2沸点低、易挥发,B为冷凝管,使挥发的产物SO2Cl2冷凝回流,碱石灰吸收为反应的二氧化硫、氯气,防止污染空气,并吸收空气中的水蒸气,防止进入C中导致磺酰氯水解。
(1)根据装置图可知,仪器B的名称为球形冷凝管,因冷凝管的作用是冷凝回流但反应没有进行加热操作,可知SO2与氯气间的反应为放热反应,△H<0;
(2)由于会有一部分Cl2、SO2通过冷凝管逸出,且SO2Cl2遇水易水解,装置C中含有碱石灰,碱石灰的作用是用于吸收氯气、SO2,防止污染环境并防止空气中的水蒸气进入B中而导致磺酰氯水解;
(3)甲是制备SO2的装置,铜与浓硫酸反应需要加热,硝酸能氧化SO2,所以要选用的合适选项是c,即用75% H2SO4+K2SO3来制备SO2;
(4)分离沸点不同的液体可以用蒸馏的方法,所以丙中混合物分离开的实验操作是蒸馏;
(5)①SO2Cl2与NaOH溶液反应生成硫酸钠和氯化钠,该反应的离子方程式为:SO2Cl2+4OH-=2Cl-+SO42-+2H2O;
②要检验溶液中的SO42-应排除Cl-的干扰,方法是取少量w溶液于试管中,加入BaCl2溶液,有白色沉淀生成,则溶液w中存在SO42-;
(6)标准状况下,896mLCl2为n(Cl2)=0.896L÷22.4L/mol=0.04mol,根据元素守恒可知理论上可得到0.04molSO2Cl2,即为m(SO2Cl2)=0.04mol×135g/mol=5.4g,因此SO2Cl2的产率为![]() =61.1%。
=61.1%。

 通城学典默写能手系列答案
通城学典默写能手系列答案【题目】用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
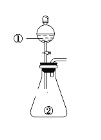
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D | 草酸溶液(H2C2O4具有还原性) | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
A.AB.BC.CD.D