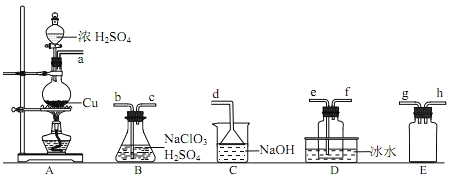
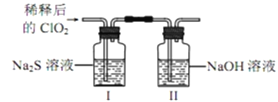
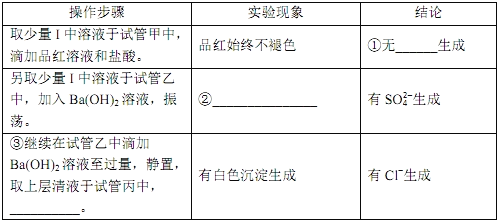
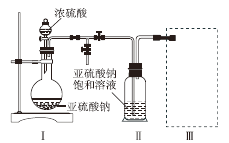
题目内容
【题目】把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如图坐标曲线来表示。下列推论错误的是( )
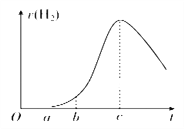
A. O~a段不产生氢气是因为表面的氧化物隔离了铝和硫酸溶液
B. b~c段产生氢气的速率增加较快的主要原因之一是温度升高
C. t>c时产生氢气的速率降低主要是因为溶液中c(H+)降低
D. t=c时反应处于平衡状态
【答案】D
【解析】A、因铝的表面有一层致密的氧化铝能与硫酸反应得到盐和水,无氢气放出,发生的反应为Al2O3+3H2SO4=Al2(SO4)3+3H2O,A正确;B、在反应过程中,浓度减小,反应速率减小,但反应放热,溶液温度升高,反应速率加快,且后者为主要因素,B正确;C、随着反应的进行,溶液中的氢离子浓度逐渐降低,所以反应速率逐渐减小,C正确;D、反应不是可逆反应,随反应进行反应放热对速率的影响比浓度减少的影响大,当t=c时温度影响最大,t>c时温度影响不是主要因素,浓度减少是主要因素,D错误;答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】钢铁行业是工业生产的重要支柱。
(1)已知高炉炼铁的主要反应为:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-25 kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47 kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+19 kJ·mol-1
写出FeO(s)被CO还原生成Fe(s)和CO2的热化学方程式:________________。
(2)恒温恒容条件下进行反应Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g),下列各项能说明该反应已达到平衡状态的是_______(填写序号字母)。
2Fe(s)+3CO2(g),下列各项能说明该反应已达到平衡状态的是_______(填写序号字母)。
a.v(CO)正=v(CO2)逆 b.CO、CO2 的浓度之比为1:1
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)ToC时,反应Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)的平衡常数为K=27。在1L的密闭容器中分别按下表所示加入物质,维持ToC反应一段时间达到平衡,甲、乙容器中CO的平衡转化率之比=_________。
2Fe(s)+3CO2(g)的平衡常数为K=27。在1L的密闭容器中分别按下表所示加入物质,维持ToC反应一段时间达到平衡,甲、乙容器中CO的平衡转化率之比=_________。
Fe2O3 | CO | Fe | CO2 | |
甲容器 | 1.0 mol | 1.0 mol | 1.0 mol | 1.0 mol |
乙容器 | 1.0 mol | 2.0 mol | 1.0 mol | 1.0 mol |
(4)下列为合成甲醇的有关化学方程式:
①2H2(g)+CO(g) ![]() CH3OH(g)
CH3OH(g)
②H2(g)+CO2(g) ![]() H2O(g)+CO(g)
H2O(g)+CO(g)
③3H2(g)+CO2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
某温度下,上述三个反应的平衡常数数值分别为2.5,2.0和K3,则K3值为_______。
(5)比亚迪双模电动汽车使用高铁电池供电。高铁电池的总反应为:3Zn(OH)2+2Fe(OH)3+4KOH![]() 3Zn+2K2FeO4+8H2O,则充电时的阳极反应式为__________。
3Zn+2K2FeO4+8H2O,则充电时的阳极反应式为__________。
(6)炼铁尾气中含有CO,经过回收可用于合成甲醇:2H2(g)+CO(g)![]() CH3OH(g) △H=-90.1 kJ·mol-1。ToC,该反应的Kp=6.0×10-3kPa-2(用平衡分压代替平衡浓度所得平衡常数,分压= 总压×物质的量分数)。该温度下的某容器中,若起始充入2molH2、1molCO,平衡时甲醇的平衡分压p(CH3OH)=24.0kPa,则平衡时混合气体中CH3OH的体积分数约为________(用百分数表示,小数点后保留1位)。
CH3OH(g) △H=-90.1 kJ·mol-1。ToC,该反应的Kp=6.0×10-3kPa-2(用平衡分压代替平衡浓度所得平衡常数,分压= 总压×物质的量分数)。该温度下的某容器中,若起始充入2molH2、1molCO,平衡时甲醇的平衡分压p(CH3OH)=24.0kPa,则平衡时混合气体中CH3OH的体积分数约为________(用百分数表示,小数点后保留1位)。
【题目】甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
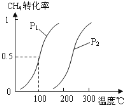
⑴①将1.0 mol CH4和2.0 mol H2O(g)通入容积100L的反应室,一定条件下发生反应:CH4(g) + H2O(g) CO(g) + 3H2(g)
Ⅰ,CH4的转化率与温度、压强的关系如图。已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为:_____________;
②图中的压强P1_________P2(填“大于”、“小于”或“等于”),100℃时的平衡常数为:_______;
③在其它条件不变的情况下降低温度,逆反应速率将__________(填“增大”、“减小”或“不变”)。
⑵在压强为0.1 MPa条件下, 将a mol CO与 3amol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g) + 2H2(g) CH3OH(g)
Ⅱ。①若容器容积不变,下列措施可提高甲醇产率的是:________________;
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.加入更高效的催化剂
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在下面实验设计的表中,请帮他完成该表。
实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) |
A | 150 | 1/3 | 0.1 |
B | Ⅰ | Ⅱ | 5 |
C | 350 | 1/3 | Ⅲ |
表中Ⅰ、Ⅱ、Ⅲ分别为:__________、____________、____________。