题目内容
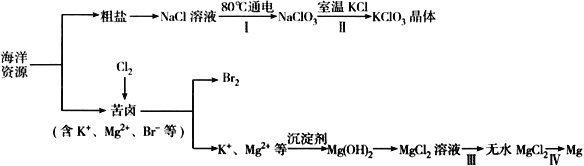
【题目】海洋资源丰富,海水水资源的利用和海水化学资源(主要为NaCl 和MgSO4 及K、Br 等元素)的利用具有非常广阔的前景。
回答下列问题:
(1)NaCl 溶液由粗盐水精制而成,为除去Ca2+和Mg2+,要加入的试剂分别为__________________、__________________。
(2)写出步骤Ⅰ 中反应的总化学方程式为NaCl+ ═NaClO3+ 。_____
(3)已知MgCl2 溶液受热时易水解(和水反应)生成Mg(OH)Cl,写出该过程的化学方程式__________________________________。
(4)步骤Ⅳ中,电解熔融MgCl2 得到的镁需要在保护气中冷却,下列气体可以作为保护气的是_______________。
A.N2 B.H2 C.CO2 D.空气
【答案】Na2CO3溶液NaOH溶液NaCl+3H2O═NaClO3+3H2↑MgCl2+H2O![]() Mg(OH)Cl+HCl↑B
Mg(OH)Cl+HCl↑B
【解析】
(1)食盐溶液中混有Mg2+ 和Ca2+,可以利用过量NaOH溶液除去Mg2+,利用过量Na2CO3溶液除去Ca2+。
(2)根据电解原理,写出方程式;
(3)根据水解原理写出水解方程式;
(4)电解熔融MgCl2得到镁蒸气和氯气,镁蒸气冷却后即为固体镁应避免镁再被氧化;
(1)食盐溶液中混有Mg2+ 和Ca2+,可以利用过量NaOH溶液除去Mg2+,利用过量Na2CO3溶液除去Ca2+。故为除去Ca2+和Mg2+,要加入的试剂分别为过量Na2CO3溶液、过量NaOH溶液;
(2)根据电解原理,阳极氯离子失去电子,被氧化成氯酸根离子,阴极水中氢得到电子被还原成氢气,方程式为NaCl+3H2O![]() NaClO3+3H2↑;
NaClO3+3H2↑;
(3)MgCl2 溶液受热时易水解(和水反应)生成Mg(OH)Cl,该过程的化学方程式MgCl2+H2O![]() Mg(OH)Cl+HCl↑;
Mg(OH)Cl+HCl↑;
(4)镁蒸气冷却后即为固体镁,冷却镁蒸气时可在H2气体氛围中进行,氮气、二氧化碳、空气都会和镁发生反应生成氮化镁、氧化镁等,故选B。

【题目】工业上消除氮氧化物的污染,可用如下反应:
CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol
N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol
在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4) | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法不正确的是
A. 10 min内,T1时v(CH4)T2时小 B. 温度:T1<T2
C. ΔH:a < 0 D. 平衡常数:K(T1)<K(T2)