题目内容
【题目】(1)已知:下列两个热化学方程式: Fe(s) + 1/2O2(g) ![]() FeO(s)
FeO(s) ![]() =-272.0KJ/mol,2Al(s) + 3/2O2(g)
=-272.0KJ/mol,2Al(s) + 3/2O2(g) ![]() Al2O3(s)
Al2O3(s) ![]() =-1675.7KJ/mol 则 Al(s)的单质和FeO(s)反应的热化学方程式是____________________________。
=-1675.7KJ/mol 则 Al(s)的单质和FeO(s)反应的热化学方程式是____________________________。
(2)对于下列反应:2SO2 + O2 ![]() 2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用O2浓度变化来表示的反应速率为_____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L· min),那么2min时SO2的浓度为 。
2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用O2浓度变化来表示的反应速率为_____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L· min),那么2min时SO2的浓度为 。
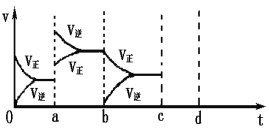
(3)如图表示在密闭容器中反应:2SO2+O2![]() 2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;
2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;
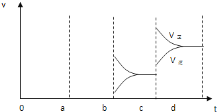
(4)若增大压强时,将反应速度变化情况画在c—d处
【答案】
(1)2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJmol-1;
(2)2mol/(Lmin),2mol/L;
(3)升温;减小SO3浓度;
(4)
【解析】
试题分析:(1)①Fe(s)+![]() O2(g)=FeO(s)△H=-272.0kJmol-1,②2Al(s)+
O2(g)=FeO(s)△H=-272.0kJmol-1,②2Al(s)+![]() O2(g)=Al2O3(s)△H=-1675.7kJmol-1,将方程式②-①×3得2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJmol-1,故答案为:2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJmol-1;
O2(g)=Al2O3(s)△H=-1675.7kJmol-1,将方程式②-①×3得2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJmol-1,故答案为:2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJmol-1;
(2)v=![]() =
=![]() mol/(Lmin)=2mol/(Lmin),同一化学反应中同一时间段内各物质的反应速率之比等于其计量数之比,所以二氧化硫的反应速率是氧气的2倍为1mol/(Lmin),2min内二氧化硫浓度的变化量为1mol/(Lmin)×2min=2mol/L,则二氧化硫的平衡浓度=4mol/L-2mol/L=2mol/L,故答案为:2mol/(Lmin),2mol/L;
mol/(Lmin)=2mol/(Lmin),同一化学反应中同一时间段内各物质的反应速率之比等于其计量数之比,所以二氧化硫的反应速率是氧气的2倍为1mol/(Lmin),2min内二氧化硫浓度的变化量为1mol/(Lmin)×2min=2mol/L,则二氧化硫的平衡浓度=4mol/L-2mol/L=2mol/L,故答案为:2mol/(Lmin),2mol/L;
(3)a时逆反应速率大于正反应速率,且正逆反应速率都增大,说明平衡应向逆反应方向移动,该反应的正反应放热,应为升高温度的结果,b时正反应速率不变,逆反应速率减小,在此基础上逐渐减小,应为减小生成物的缘故,故答案为:升温;减小SO3浓度;
(4)若增大压强时,平衡向正反应方向移动,则正逆反应速率都增大,且正反应速率大于逆反应速率,图象应为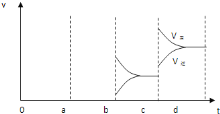 ,故答案为:
,故答案为: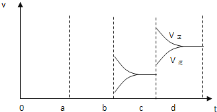 。
。

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案【题目】已知:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH=-123 kJ·mol-1。其中相关的化学键键能数据如下:
化学键 | H—Cl | O===O | Cl—Cl | H—O |
E/ kJ·mol-1 | 431 | 497 | a | 465 |
其中a值为( )
A. 242 B. 303.5 C. 180.5 D. 365