题目内容
将Cu片放入0.l mol / L FeCl3溶液中,一定时间后取出Cu片,溶液中c(Fe3+)∶c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为
| A.3 : 2 | B.3 : 5 | C.4 : 3 | D.3 : 4 |
D
设参加反应的铜的物质的量是x,则根据方程式Cu+2Fe3+=Cu2++2Fe2+可知,消耗铁离子是2x,生成亚铁离子是2x,则溶液中铁离子的物质的量是2/3×2x=4x/3,所以溶液中铜离子和铁离子的物质的量之比是3 : 4,答案选D。

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
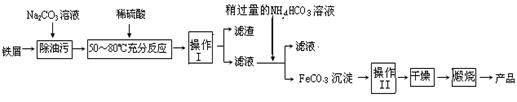
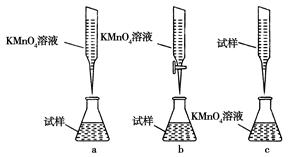
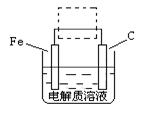
 ==6SO2+Fe3O4,氧化产物为 ,若有3 mol FeS2参加反应,
==6SO2+Fe3O4,氧化产物为 ,若有3 mol FeS2参加反应,
 况下的气体672 mL,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水,则通入的氧气的体积为
况下的气体672 mL,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水,则通入的氧气的体积为