题目内容
4.用NA代表阿伏加德罗常数,下列说法正确的是( )| A. | 0.2NA个CO分子在标准状况下的体积约是4.48 L | |
| B. | 0.1mol/L BaCl2溶液中Cl-数目是0.2 NA | |
| C. | 4℃时,22.4 L水中含有的电子数目为10NA个 | |
| D. | 使23g钠变为 Na+,需失去0.1NA个电子 |
分析 A、根据体积V=$\frac{N}{{N}_{A}}Vm$来计算;
B、溶液体积不明确;
C、求出水的质量和物质的量,然后根据水为10电子微粒来分析;
D、求出钠的物质的量,然后根据反应后钠变为+1价来计算.
解答 解:A、CO的体积V=$\frac{N}{{N}_{A}}Vm$=$\frac{0.2{N}_{A}}{{N}_{A}}mol×22.4L/mol$=4.48L,故A正确;
B、溶液体积不明确,故溶液中的氯离子的个数无法计算,故B错误;
C、4℃时,水的密度为1g/mL,故22.4L水的质量为2.24×104g,其物质的量n=$\frac{2.24×1{0}^{4}g}{18g/mol}$=1244.4mol,而水为10电子微粒,故1244.4mol水中含12444mol电子,故C错误;
D、23g钠的物质的量为1mol,根据反应后钠变为+1价,故1mol钠失去1mol电子即NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
14.下列说法不正确的是( )
| A. | pH相同的①CH3COONa②NaHCO3两种溶液的c(Na+):②>① | |
| B. | 反应2A(s)+B(g)=2C(g)+D(g)不能自发进行,则该反应△H一定大于0 | |
| C. | 向明矾溶液中逐滴加入氢氧化钡溶液至硫酸根离子刚好沉淀完全时,溶液呈碱性 | |
| D. | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深,这一事实可以用勒夏特列原理解释 |
12.某溶液中含有Cl-、K+、H+、SO42-,组成该溶液的化合物最多有( )
| A. | 2种 | B. | 3 种 | C. | 5种 | D. | 6种 |
19.把8gNaOH固体溶解于105mL水后得到100mL溶液,则该NaOH溶液的物质的量浓度为( )
| A. | 2mol•L-1 | B. | 7.8mol•L-1 | C. | 8mol•L-1 | D. | 1.9mol•L-1 |
9.下列电离方程式错误的是( )
| A. | Al2(SO4)3═2Al3++3SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | Ba(OH)2═Ba2++2OH- | D. | Na2SO4═2Na++SO42- |
13.有下列四组物质,每组内物质互为同分异构体的是( )
| A. | 12C和14C | B. | 金刚石与石墨 | ||
| C. | CH3CHO与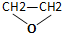 | D. | CH3CHCH2CH3与CH3CH2CH2CHCH3 |
14.对于密闭容器中进行的反应:P(g)+Q(g)?R(g)+S(g)下列说法可以充分说明这一反应已经达到化学平衡状态的是( )
| A. | P、Q、R、S的物质的量浓度之比为:1:1:1:1 | |
| B. | P、Q、R、S在密闭容器中共存 | |
| C. | P、Q、R、S的物质的量浓度不再变化 | |
| D. | v(Q)=v(R) |
