题目内容
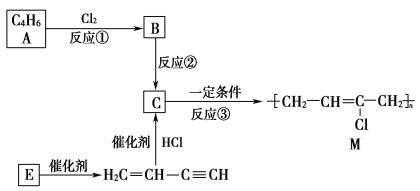
【题目】氯丁橡胶M是理想的电线电缆材料,工业上可由有机化工原料A或E制得,其合成路线如图所示。
完成下列填空:
(1)A的名称是________________,反应③的反应类型是________。
(2)写出反应②的化学反应方程式:_____________________________________。
(3)为研究物质的芳香性,将E三聚、四聚成环状化合物,写出它们的结构简式:________________________。鉴别这两个环状化合物的试剂为________。
【答案】1,3丁二烯加聚反应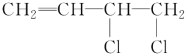 +NaOH
+NaOH![]()
 +NaCl+H2O
+NaCl+H2O![]() 、
、![]() 溴水(或高锰酸钾酸性溶液)
溴水(或高锰酸钾酸性溶液)
【解析】
此题采用逆推法:由H2C===CH—C≡CH![]() C,不难看出C应为
C,不难看出C应为![]() ,据此分析可得结论。
,据此分析可得结论。
(1)经分析A分子中含有两个双键,且分子式为C4H6,故A为1,3丁二烯,反应③为加聚反应,故答案为:1,3丁二烯、加聚反应;(2)反应②为卤代烃的消去反应,方程式为:![]() +NaOH
+NaOH![]()
![]() +NaCl+H2O;(3)经分析物质E为乙炔,三聚、四聚的环状化合物分别为:
+NaCl+H2O;(3)经分析物质E为乙炔,三聚、四聚的环状化合物分别为:![]() 、
、![]() ,苯分子中是没有碳碳双键的,而环辛四烯分子中含有双健,可用溴水或酸性高锰酸钾溶液来鉴别,故答案为:
,苯分子中是没有碳碳双键的,而环辛四烯分子中含有双健,可用溴水或酸性高锰酸钾溶液来鉴别,故答案为:![]() 、
、![]() 、溴水(或高锰酸钾酸性溶液)。
、溴水(或高锰酸钾酸性溶液)。

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目