题目内容
14.实验室要配制100mL 0.5mol/L的NaCl溶液,试回答下列各题:(1)下列仪器中,肯定不会用到的是AB:
A.锥形瓶 B.200mL容量瓶 C.胶头滴管 D.100mL容量瓶 E.天平
(2)若要实施配制,除上述仪器外,还缺少的仪器是烧杯、玻璃棒.
(3)容量瓶上除有刻度线外还应标有温度、容量,容量瓶在使用前必须进行的一步操作是查漏.(4)配制完毕后,老师指出有四位同学各进行了下列某一项错误操作,你认为这四项错误操作会导致所得溶液浓度偏高的是B:
A.定容时仰视容量瓶刻度线
B.定容时俯视容量瓶刻度线
C.将溶解冷却后的溶液转入容量瓶后就进行定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
(5)通过计算需用托盘天平称取NaCl固体2.9g;若用4mol/L的NaCl浓溶液配制100mL 0.5mol/L的稀溶液,需用量筒量取12.5mL该浓溶液.
分析 (1)(2)根据实验操作步骤确定每步操作需要仪器,然后判断用不到的仪器、还缺少仪器名称;
(3)依据容量瓶的构造及使用方法解答;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(5)依据m=CVM计算需要溶质的质量;依据溶液稀释规律解答.
解答 解:(1)(2)配制一定物质的量浓度溶液的一般步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,用到的仪器:烧杯、玻璃棒、托盘天平、100mL容量瓶、胶头滴管;
用不到的仪器为:A.锥形瓶;B.200mL容量瓶;
还需要的仪器:烧杯、玻璃棒;
(1)故答案为:AB;
(2)烧杯、玻璃棒;
(3)容量瓶上除有刻度线外还应标有温度、容量;使用前用检查是否漏水;
故答案为:温度、容量; 查漏;
(4)A.定容时仰视容量瓶刻度线,导致溶液体积偏大,溶液浓度偏低,故不选;
B.定容时俯视容量瓶刻度线,导致溶液体积偏小,溶液浓度偏高,故选;
C.将溶解冷却后的溶液转入容量瓶后就进行定容操作,未进行洗涤操作,导致溶质的物质的量偏小,溶液浓度偏低,故不选;
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处,导致溶液体积偏大,溶液浓度偏低,故不选;
故选:B;
(5)配制100mL 0.5mol/L的NaCl溶液,需要氯化钠的质量=0.5mol/L×0.1L×58.5g/mol=2.9g;
若用4mol/L的NaCl浓溶液配制100mL 0.5mol/L的稀溶液,设需要浓溶液体积为V,则依据溶液稀释过程中物质的量不变得:4mol/L×V=100mL×0.5mol/L;
解得V=12.5mL;
故答案为:2.9;12.5.
点评 本题考查了一定物质的量浓度溶液的配制,熟悉配制原理、熟悉容量瓶规格的选择及使用方法是解题关键,题目难度不大.

| A. | Fe(OH)3?Fe3++3OH- | B. | NaHCO3?Na++HCO3- | ||
| C. | KClO3═K++Cl-+3O2- | D. | H2S?2H++S2- |
| A. | NaOH | B. | Ba(OH)2 | C. | Fe(OH)3 | D. | NH3•H2O |
C2H4(g)+H2O(g)=C2H5OH(g)△H=-45.8kJ/mol
则下列说法中正确的是( )
| A. | 实验中,乙烯的用量不会影响该反应的反应焓变△H | |
| B. | 0.5 mol H2O(l) 完全反应放出的热量为22.9 kJ | |
| C. | 1 mol C2H5OH(g)具有的能量大于1 mol C2H4(g)和1 mol H2O (g)所具有的能量和 | |
| D. | 1 mol C2H4(g)和1 mol H2O (g)中化学键的总键能大于1 mol C2H5OH(g)中化学键的总键能 |
| A. | 不溶于水,且必须易与碘发生化学反应 | |
| B. | 不溶于水,且比水更容易使碘溶解 | |
| C. | 不溶于水,且必须比水密度大 | |
| D. | 不溶于水,且必须比水密度小 |
| A. | 2LCO和2L CO2 | |
| B. | 9克H2O和标准状况下11.2L CO2 | |
| C. | 标准状况下1mol O2和22.4L H2O | |
| D. | 0.2mol H2和标准状况下4.48L HCl气体 |
| A. | 标准状况下,2.24 L HF含有的HF分子数为0.1NA | |
| B. | 在常温常压下,32 g 18O2中含有2NA氧原子 | |
| C. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| D. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA |
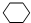 ,名称是环己烷,该烃的二氯代物有4种.
,名称是环己烷,该烃的二氯代物有4种.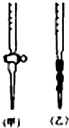 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.