题目内容
【题目】将 54.8g Na2CO3和 NaHCO3 的混合物分成等量的两份,一份溶于水后加入足量某浓度的盐酸,收集到气体 V L.另一份直接加热至恒重,生成气体 2.24L(所有气体体积均在标准状况下测定).试准确计算出:
(1)原固体混合物中 Na2CO3的物质的量:nNa2CO3)=_____
(2)V=_____L.
【答案】 0.2mol 6.72
【解析】试题分析: Na2CO3和 NaHCO3都能与盐酸反应放出二氧化碳气体;加热时只有NaHCO3分解放出二氧化碳气体。
解析:设每份固体中NaHCO3的质量为xg
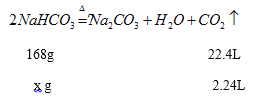
![]()
X=16.8g
原固体混合物中 Na2CO3质量是54.8g-16.8g×2=21.2g,
nNa2CO3)=![]() ;
;
(2)设每份固体中碳酸钠的质量为10.6g,碳酸钠与盐酸反应放出二氧化碳气体的体积为V1L,每份固体中碳酸钠的质量为16.8g,碳酸氢钠与盐酸反应放出二氧化碳气体的体积为V2L,
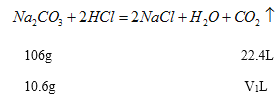
![]()
V1=2.24L
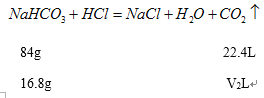
![]()
V2=4.48L
V=4.48L +2.24L =6.72L。

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是
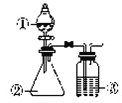
选项 | ① | ② | ③ | 实验结论 |
A | 酸性高锰酸钾 | 浓盐酸 | NaHCO3溶液 | Cl2与水反应生成酸性物质 |
B | 浓硫酸 | 蔗糖 | 澄清石灰水 | 浓硫酸具有脱水性、氧化性 |
C | 浓硝酸 | 铁片 | NaOH溶液 | 铁和浓硝酸反应可生成NO |
D | 稀盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
A. A B. B C. C D. D
