题目内容
【题目】下列图示与对应的叙述不相符的是
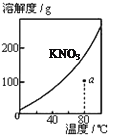
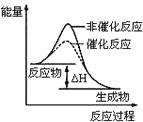

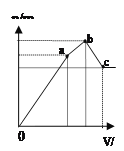
图1 图2 图3 图4
A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示反应aA(g)+bB(g)![]()
![]() cC(g)表示改变某一条件对化学平衡的影响, 若p1>p2此反应自发进行,必须满足的条件是低温
cC(g)表示改变某一条件对化学平衡的影响, 若p1>p2此反应自发进行,必须满足的条件是低温
D.图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化
【答案】C
【解析】
A、硝酸钾的溶解度随着温度的升高而增大,溶解度曲线下方的点是不饱和溶液的点,故A正确;
B、反应物大于生成物的总能量,则反应是放热反应,加入催化剂会降低活化能,改变反应的速率,但反应热不改变,故B正确;
C、从图象可见,随压强增大A的转化率增大,说明加压时平衡正向移动,则a+b>c,△S<0,随温度升高A的转化率降低,说明升温时平衡逆向移动,则△H<0,当△H-T△S<0时,反应自发进行,低温时,△H-T△S<0,反应都能自发进行,故C不正确;
D. 向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液时,关键弄清楚反应顺序,开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当1molAl3+沉淀完全时需加入3molOH-,即加入1.5molBa(OH)2,加入的Ba2+为1.5mol,SO42-未完全沉淀,此时溶液含有硫酸铵、硫酸铝;(开始到a)再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3H2O,所以沉淀质量继续增加;当SO42-完全沉淀时,共需加入2molBa(OH)2,加入4molOH-,Al3+反应掉3molOH-,生成Al(OH)31mol,剩余1molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液;(a到b)继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使1molAl(OH)3完全溶解,需再加入0.5molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液,(b到c),故D正确;
故答案选C。

 步步高达标卷系列答案
步步高达标卷系列答案【题目】碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS 等)来制备,其工艺流程如下:

回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为_________________________;
(2)“溶解”时放出的气体为_______________ (填化学式);
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH 1”时,溶液pH范围为______________________;
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式_____________;

(5)金属铬在溶液中有多种存在形式, CrO42—和Cr2O72—在溶液中可相互转化。室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72—)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应________________,根据A点数据计算出该转化反应的平衡常数为______________,温度升高,溶液中CrO42—的平衡转化率减小,则该反应的△H____0(填“>”、“<”或“=”)。