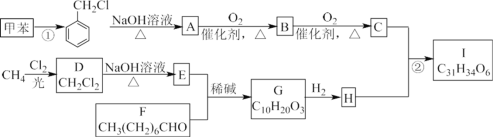
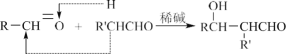题目内容
【题目】低碳经济成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。请你结合下列有关图示和所学知识回答:
(1)用CO2催化加氢可以制取乙烯:CO2(g)+3H2(g)![]() C2H4(g)+2H2O(g)。若该反应体系的能量随反应过程变化关系如图所示,则该反应的ΔH=___(用含a、b的式子表示)。又知:相关化学键的键能如下表所示,实验测得上述反应的ΔH=-152kJ·mol-1,则表中的x=___。
C2H4(g)+2H2O(g)。若该反应体系的能量随反应过程变化关系如图所示,则该反应的ΔH=___(用含a、b的式子表示)。又知:相关化学键的键能如下表所示,实验测得上述反应的ΔH=-152kJ·mol-1,则表中的x=___。

化学键 | C=O | H—H | C=C | C—H | H—O |
键能/kJ·mol-1 | 803 | 436 | x | 414 | 464 |
(2)键能是将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。已知下列化学键的键能如下表:
化学键 | N≡N | O | N—N | N—H | O—H |
946 | 497 | 193 | 391 | 463 |
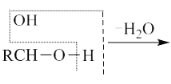
写出1mol气态肼(H2N—NH2)燃烧生成氮气和水蒸气的热化学方程式:___。
(3)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
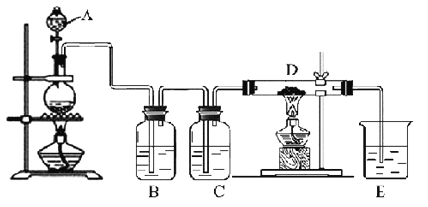
①科学家提出由CO2制取C的太阳能工艺如图所示。
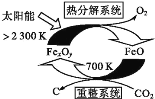
若“重整系统”发生的反应中![]() =6,则FexOy的化学式为___。“热分解系统”中每分解1molFexOy,转移电子的物质的量为___。
=6,则FexOy的化学式为___。“热分解系统”中每分解1molFexOy,转移电子的物质的量为___。
②工业上用CO2和H2反应合成二甲醚。已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1,CH3OCH3(g)+H2O(g)=2CH3OH(g) ΔH2=+23.4kJ·mol-1,则2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH3=___kJ·mol-1。
CH3OCH3(g)+3H2O(g) ΔH3=___kJ·mol-1。
【答案】-(b-a)kJ·mol-1 764 N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-544kJ·mol-1 Fe3O4 2mol -130.8
【解析】
(1)根据ΔH=反应物的键能总和-生成物的键能总和、ΔH=反应物键能总和-生成物键能总和进行计算;
(2)气态肼燃烧生成氮气和水蒸气,写出方程式,根据ΔH=反应物的键能总和-生成物的键能总和进行计算;
(3)①由图可知重整系统中CO2和FeO反应生成FexOy和C,根据原子守恒确定化学式;热分解系统中是FexOy分解为FeO和氧气,根据铁元素化合价变化计算转移的电子的物质的量;
②根据盖斯定律计算反应热并书写热化学方程式。
(1)由图知1molCO2(g)和3molH2(g)具有的总能量大于1molC2H4(g)和2molH2O(g)具有的总能量,该反应为放热反应,反应的ΔH=生成物具有的总能量-反应物具有的总能量=-(b-a)kJ·mol-1。反应热ΔH=反应物的键能总和-生成物的键能总和=2×803kJ·mol-1+3×436kJ·mol-1-[xkJ·mol-1+2×414kJ·mol-1+4×464 kJ·mol-1]=-152kJ·mol-1,解得x=764;
(2)气态肼和氧气反应的化学方程式为N2H4(g)+O2(g)![]() N2(g)+2H2O(g)。根据焓变=反应物总键能-生成物总键能,1mol气态肼(H2N—NH2)燃烧生成氮气和水蒸气的焓变=193kJ·mol-1+391kJ·mol-1×4+497kJ·mol-1-946kJ·mol-1-463 kJ·mol-1×4=-544kJ·mol-1,所以1mol气态肼(H2N—NH2)燃烧生成氮气和水蒸气的热化学方程式是N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-544 kJ·mol-1;
N2(g)+2H2O(g)。根据焓变=反应物总键能-生成物总键能,1mol气态肼(H2N—NH2)燃烧生成氮气和水蒸气的焓变=193kJ·mol-1+391kJ·mol-1×4+497kJ·mol-1-946kJ·mol-1-463 kJ·mol-1×4=-544kJ·mol-1,所以1mol气态肼(H2N—NH2)燃烧生成氮气和水蒸气的热化学方程式是N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-544 kJ·mol-1;
(3)①由示意图可以知道,重整系统中CO2和FeO反应生成FexOy和C,发生的反应中![]() =6时,根据铁原子、氧原子守恒可以知道x∶y=6∶(6+2)=3∶4,故FexOy的化学式为Fe3O4;热分解系统中是Fe3O4分解为FeO与氧气,分解1molFe3O4转移电子的物质的量为1mol×3×(-2)=2mol;
=6时,根据铁原子、氧原子守恒可以知道x∶y=6∶(6+2)=3∶4,故FexOy的化学式为Fe3O4;热分解系统中是Fe3O4分解为FeO与氧气,分解1molFe3O4转移电子的物质的量为1mol×3×(-2)=2mol;
②已知:Ⅰ.CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1,Ⅱ.CH3OCH3(g)+H2O(g)=2CH3OH(g) ΔH2=+23.4 kJ·mol-1,根据盖斯定律知2×反应Ⅰ-反应II得2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH3=-130.8kJ·mol-1。
CH3OCH3(g)+3H2O(g) ΔH3=-130.8kJ·mol-1。