题目内容
【题目】京津冀及周边区域遭遇“跨年”雾霾,二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,消除氮氧化物污染是研究方向之一。
![]() 用
用![]() 催化还原氮氧化物可以消除氮氧化物的污染。已知:
催化还原氮氧化物可以消除氮氧化物的污染。已知:
![]()
![]()
![]()
![]()
![]()
![]()
请写出![]()
![]() 与
与![]()
![]() 反应生成
反应生成![]()
![]() ,
,![]() 和
和![]() 的热化学方程式__________。
的热化学方程式__________。
![]() 用活性炭还原法处理氮氧化物。有关反应为:
用活性炭还原法处理氮氧化物。有关反应为:![]()
![]() ,某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温
,某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温![]() 条件下反应,反应进行到不同时间测得各物质的浓度如下:
条件下反应,反应进行到不同时间测得各物质的浓度如下:
NO |
|
| |
0 |
| 0 | 0 |
10 |
|
|
|
20 |
|
|
|
30 |
|
|
|
40 |
|
|
|
50 |
|
|
|
![]() 下列说法不能作为判断该反应达到化学平衡状态标志的是_______
下列说法不能作为判断该反应达到化学平衡状态标志的是_______
A 活性炭的质量 ![]()
C 容器内压强保持不变 ![]() 容器内混合气体的密度保持不变
容器内混合气体的密度保持不变
E 容器内混合气体的平均相对分子质量保持不变
F 容器内![]() 的浓度保持不变
的浓度保持不变
![]() 在
在![]() 时,该反应的平衡常数为_________
时,该反应的平衡常数为_________![]() 小数点后保留两位有效数字
小数点后保留两位有效数字![]() ;
;
![]() 在
在![]() 时,若只改变某一条件,反应重新达到平衡,则改变的条件是___________;
时,若只改变某一条件,反应重新达到平衡,则改变的条件是___________;
![]() 在
在![]() 时保持温度和容器体积不变再充入NO和
时保持温度和容器体积不变再充入NO和![]() ,使二者的浓度均增加至原来的两倍,则化学平衡_______
,使二者的浓度均增加至原来的两倍,则化学平衡_______![]() 填“正向移动”、“逆向移动”或“不移动”
填“正向移动”、“逆向移动”或“不移动”![]()
![]() 利用反应
利用反应![]() 构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。
构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。
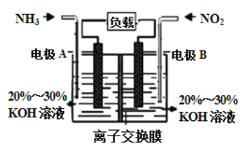
A电极的电极反应式为______________
【答案】![]()
![]() 、C
、C ![]() 减小
减小![]() 浓度 正向移动
浓度 正向移动 ![]()
【解析】
(1)根据盖斯定律计算所求反应的焓变;
(2)①混合气体的密度为ρ=![]() ,混合气体的平均相对分子质量为M=
,混合气体的平均相对分子质量为M=![]() ,据此逐项分析;
,据此逐项分析;
②根据反应方程式和平衡浓度计算反应的化学平衡常数;
③30min时是原平衡,30min后改变了条件,反应在40min时达到新的平衡,此时N2的平衡浓度大于CO2的平衡浓度,据此分析;
④根据浓度商和平衡常数的关系判断化学反应进行的方向;
(3)①A电极上通入NH3参加反应,NH3转化为N2,过程失电子,则A电极为负极,考虑到电解质溶液是碱性介质,所以应为OH-参与反应,生成H2O;
②A.A电极为负极,电子从负极流向正极;
B.原电池中,阴离子向负极移动,阳离子向正极移动;
C.根据正负极电极反应分析溶液pH变化;
D.标准状况下,4.48LNO2气体的物质的量为0.2mol,转移电子数为0.8mol,未说明标准状况。
![]() 已知:
已知:![]() ,
,
![]() ,
,
![]() ,
,
![]()
![]() 与
与![]()
![]() 反应生成
反应生成![]()
![]() ,
,![]() 和
和![]() 的化学方程式为:
的化学方程式为:![]() ,反应可由
,反应可由![]() 得到,根据盖斯定律,反应的焓变
得到,根据盖斯定律,反应的焓变![]() ,
,
故答案为:![]() ;
;
![]() 当反应达到化学平衡时,活性炭的质量不改变,所以活性炭的质量能说明反应是否达到平衡,故A正确;
当反应达到化学平衡时,活性炭的质量不改变,所以活性炭的质量能说明反应是否达到平衡,故A正确;
B.反应达到化学平衡时,速率关系应为![]() ,故B错误;
,故B错误;
C.反应为气体分子总数不变的反应,反应达到平衡前后,体系压强不改变,不能说明化学反应是否达到平衡,故C错误;
D.混合气体的密度为![]() ,反应前后气体总质量发生改变,m发生变化,体积V不变,达到平衡前后混合气体的密度是改变的,所以可以说明反应是否达到化学平衡,故D正确;
,反应前后气体总质量发生改变,m发生变化,体积V不变,达到平衡前后混合气体的密度是改变的,所以可以说明反应是否达到化学平衡,故D正确;
E.混合气体的平均相对分子量为![]() ,反应前后气体总质量发生改变,m发生变化,反应前后气体总物质的量n不变,所以反应达到平衡前后混合气体的平均分子量发生变化,可以说明反应是否达到平衡,故E正确;
,反应前后气体总质量发生改变,m发生变化,反应前后气体总物质的量n不变,所以反应达到平衡前后混合气体的平均分子量发生变化,可以说明反应是否达到平衡,故E正确;
F.反应达到平衡时![]() 的浓度不变,可以说明反应是否达到化学平衡,故F正确,
的浓度不变,可以说明反应是否达到化学平衡,故F正确,
故答案为:B、C;
![]() 反应方程式为
反应方程式为![]() ,根据表格数据,原平衡时
,根据表格数据,原平衡时![]() ,
,![]() ,
,![]() ,所以反应的平衡常数为
,所以反应的平衡常数为![]() ,
,
故答案为:![]() ;
;
![]() 时是原平衡,30min后改变了条件,反应在40min时达到新的平衡,此时
时是原平衡,30min后改变了条件,反应在40min时达到新的平衡,此时![]() 的平衡浓度大于
的平衡浓度大于![]() 的平衡浓度,说明改变的条件是浓度项,应为降低了
的平衡浓度,说明改变的条件是浓度项,应为降低了![]() 的浓度,使得平衡正向移动,最终
的浓度,使得平衡正向移动,最终![]() 的浓度大于原平衡的浓度,符合表格数据,
的浓度大于原平衡的浓度,符合表格数据,
故答案为:减小![]() 浓度;
浓度;
![]() 在50min时保持温度和容器体积不变再充入NO和
在50min时保持温度和容器体积不变再充入NO和![]() ,使二者的浓度均增加至原来的两倍,则浓度商
,使二者的浓度均增加至原来的两倍,则浓度商![]() ,则反应正向进行,
,则反应正向进行,
故答案为:正向移动;
![]() 电极上通入
电极上通入![]() 参加反应,
参加反应,![]() 转化为
转化为![]() ,过程失电子,则A电极为负极,考虑到电解质溶液是碱性介质,所以应有
,过程失电子,则A电极为负极,考虑到电解质溶液是碱性介质,所以应有![]() 参与反应,生成
参与反应,生成![]() ,则A电极的电极反应式为:
,则A电极的电极反应式为:![]() ,
,
故答案为:![]() 。
。

 名校课堂系列答案
名校课堂系列答案【题目】关于铝热反应的现象有如下描述:反应放出大量的热,并发出耀眼的光芒;纸漏斗的下部被烧穿,有熔融物落入沙中。已知![]() 、
、![]() 、
、![]() 、
、![]() 的熔点、沸点如表所示:
的熔点、沸点如表所示:
物质 |
|
|
|
|
熔点/℃ | 660 | 1565 | 2054 | 1535 |
沸点/℃ | 2467 | 3414 | 2980 | 2750 |
(1)某同学推测,铝热反应所得到的熔融物是铁铝合金,因为该反应放热能使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝形成铁铝合金。你认为他的解释是否合理?________(填“合理”或“不合理”)。
(2)设计一个简单的实验,证明上述熔融物中含有金属铝,填写下列表格:
①所用试剂 | ______ |
②实验操作及现象 | ______ |
③有关反应的化学方程式 | ______ |
(3)欲在常温下溶解该熔融物,下列试剂中最好选用______(填序号),理由是_________________________。
a.浓硫酸 b.稀硫酸 c.硫酸锌溶液d. ![]() 溶液
溶液