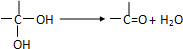
题目内容
16.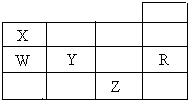 如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )| A. | X、Y、Z的阴离子电子层结构均与R原子的相同 | |
| B. | 常压下,Y单质的沸点比Z单质的沸点高 | |
| C. | W的氢化物的稳定性比X的氢化物的稳定性强 | |
| D. | 最高价氧化物的水化物酸性W比Y强 |
分析 由X、W、Y、R、Z五种元素在周期表中位置可知,X为N元素、W为P元素、Y为S元素、R为Ar元素、Z为Br元素.根据元素所在周期表中的位置,结合元素周期律的递变规律进行判断.
解答 解:由X、W、Y、R、Z五种元素在周期表中位置可知,X为N元素、W为P元素、Y为S元素、R为Ar元素、Z为Br元素.
A.X为N,阴离子比Ar少一个电子层,Y为S元素,Z为Br元素,R为Ar元素,Y的阴离子电子层结构R原子的相同,Z的阴离子电子层结构与R原子的不相同,Z的阴离子多1个电子层,故A错误;
B.常温下S为固体,溴为液体,则S的沸点高,故B正确;
C.同主族元素从上到下元素的非金属性逐渐减弱,对应的氢化物的稳定性减弱,故C错误;
D.同周期元素从左到右元素的非金属性逐渐增强,所以非金属性Y>W,元素的非金属性越强,对应最高价氧化物的水化物的酸性越强,所以最高价氧化物对应水化物的酸性:Y>W,故D错误.
故选B.
点评 本题考查位置结构性质的相互关系应用,题目难度不大,正确推断元素为解答该题的关键,注意把握元素周期律的递变规律.

练习册系列答案
相关题目
7.下列说法正确的是( )
| A. | 只有活泼金属与活泼非金属元素原子之间才能形成离子键 | |
| B. | Na2O2中阳离子和阴离子个数比为1:1 | |
| C. | 形成离子键的阴、阳离子间只有静电吸引力 | |
| D. | 共价键存在于共价化合物中,也可能存在于单质及离子化合物中 |
8.对于物质的量相同的硫酸(H2SO4)和磷酸(H3PO4),下列说法中不正确的是( )
| A. | 分子数相同 | B. | 氧原子个数相等 | C. | 氢原子个数相等 | D. | 质量相等 |
5.把盛有甲烷和氯气混合物的密闭容器放在光亮的地方,二者反应,下列叙述不正确的是( )
| A. | 容器内的原子总数不变 | B. | 容器内的分子总数不变 | ||
| C. | 容器内的压强保持不变 | D. | 容器内物质总质量不变 |
6.常温下,已知某NaHSO3溶液的pH=4,则有关NaHSO3溶液的说法转正确的是( )
| A. | NaHSO3溶液中水的电离程度小于Na2SO3 溶液,也小于Na2SO4 溶液 | |
| B. | [HSO3-]>[SO32-]>[H2SO3 ] | |
| C. | 该溶液中由水电离出的[H+]为1×10-4mol/L | |
| D. | 加入少量NaOH使溶液的pH升高会使水的电离受到抑制 |


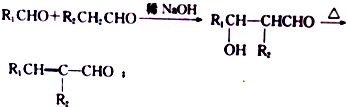
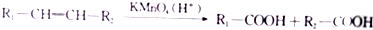
 .
. +(2n-1)H2O.
+(2n-1)H2O. (写出其中一种结构简式).
(写出其中一种结构简式).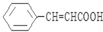 )的合成路线示意图.
)的合成路线示意图.