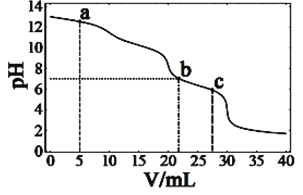
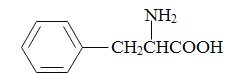题目内容
【题目】单质硼是冶金、建材、化工、核工业等部门的重要原料,而金属镁也广泛应用于航空航天等国防军事工业。以铁硼矿为原料,利用碳碱法工艺生产硼和镁,其工艺流程图如下:
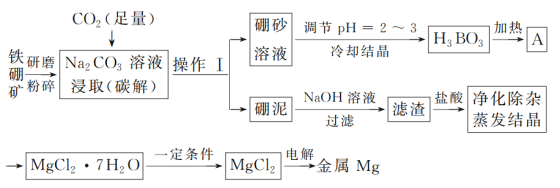
已知:铁硼矿的主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Al2O3和SiO2杂质;硼砂的化学式为Na2B4O7·10H2O。
(1)铁硼矿研磨粉碎的目的是____________;操作Ⅰ的名称为___;硼泥中除杂质SiO2和Al2O3外,其他成分的化学式为_______。
(2)写出流程图中碳解过程的化学方程式:__________;在高温条件下金属Mg与A反应制备单质硼的化学方程式为:__________。
(3)碳碱工艺需两次调节pH:①常用H2SO4调节硼砂溶液pH=2~3制取H3BO3,其离子方程式为B4O72-+2H++5H2O=4H3BO3;②制取MgCl2·7H2O时,在净化除杂过程中,需先加H2O2溶液,其作用是_______,然后用MgO调节pH约为5,其目的是_____。
(4)用MgCl2·7H2O制取MgCl2时,为防止MgCl2水解,反应需在“一定条件下”进行,则该条件是指_____。
(5)实验时不小心触碰到NaOH溶液,可用大量清水冲洗,再涂抹H3BO3溶液中和,其化学方程式为:NaOH+H3BO3=Na[B(OH)4],下列关于Na[B(OH)4]溶液中微粒浓度关系正确的是___。
A c(Na+)+c(H+)=c([B(OH)4]-)+c(OH-)
B c(Na+)>c([B(OH)4]-)>c(H+)>c(OH-)
C c(Na+)=c([B(OH)4]-)+c(H3BO3)
【答案】增大反应物的接触面积;加快化学反应速率;提高原料利用率(任选一条) 过滤 Fe3O4、MgCO3 2Mg2B2O5+Na2CO3+3CO2=Na2B4O7+4MgCO3 3Mg+B2O3![]() 2B+3MgO 将Fe2+氧化为Fe3+ 使Fe3+形成氢氧化物沉淀而除去 干燥的HCl气氛、加热 AC
2B+3MgO 将Fe2+氧化为Fe3+ 使Fe3+形成氢氧化物沉淀而除去 干燥的HCl气氛、加热 AC
【解析】
铁硼矿的主要成分为Mg2B2O5H2O和Fe3O4,含有少量Al2O3和SiO2等,碳解得到硼砂溶液(Na2B4O710H2O),过滤分离,碳解发生反应:2Mg2B2O5H2O+Na2CO3+3CO2=Na2B4O7+2H2O+4MgCO3。硼砂溶液调节pH得到硼酸,加热分解得到A为B2O3。硼泥中含有MgCO3、Fe3O4、Al2O3、SiO2等,加入氢氧化钠溶液,Al2O3、SiO2溶解,滤渣中含有MgCO3、Fe3O4,再用盐酸溶解,得到溶液中含有MgCl2、FeCl2、FeCl3,加H2O2溶液将亚铁离子氧化为铁离子,再调节溶液pH,使铁离子转化为氢氧化铁沉淀过滤除去,滤液经过蒸发浓缩、冷却结晶得到MgCl27H2O,为防止氯化镁水解,在HCl环境下加热失去结晶水,最后电解熔融氯化镁得到Mg。
(1)将铁硼矿研磨粉碎可以增大反应物的接触面积,加快化学反应速率,提高原料的利用率等;铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Al2O3和SiO2)碳解生成硼砂,碳解过程的化学方程式为:2Mg2B2O5+Na2CO3+3CO2=Na2B4O7+4MgCO3,生成的MgCO3以及原料中的Fe3O4、Al2O3和SiO2均不与Na2CO3反应,经过滤后得到硼砂溶液和硼泥;
(2)碳解过程的化学方程式为:2Mg2B2O5+Na2CO3+3CO2=Na2B4O7+4MgCO3;硼酸受热分解的化学方程式为:2H3BO3![]() 3H2O+B2O3,A为B2O3,Mg与B2O3反应制备硼的化学方程式为:3Mg+B2O3
3H2O+B2O3,A为B2O3,Mg与B2O3反应制备硼的化学方程式为:3Mg+B2O3 2B+3MgO;
2B+3MgO;
(3)净化除杂过程中加入H2O2的作用是将Fe2+氧化为Fe3+,其离子方程式为:2H++H2O2+2Fe2+=2Fe3++2H2O,用MgO调节溶液pH约为5,其目的是使Fe3+形成氢氧化物沉淀而除去;
(4)用MgCl2·7H2O制取MgCl2时,为防止MgCl2水解,反应需在干燥的HCl气氛和加热条件下进行;
(5)根据化学方程式NaOH+H3BO3=Na[B(OH)4],可确定溶液中阳离子为H+和Na+,阴离子为[B(OH)4]-和OH-,由电荷守恒:c(Na+)+c(H+)=c([B(OH)4]-)+c(OH-),A项正确;[B(OH)4]-水解使溶液呈碱性,故c(Na+)>c([B(OH)4]-)>c(OH-)>c(H+),B项错误;由物料守恒:c(Na+)=c([B(OH)4]-)+c(H3BO3),C项正确。答案选AC。

 计算高手系列答案
计算高手系列答案【题目】下列实验对相应的现象解释不正确的是
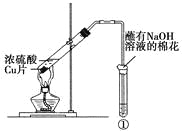
选项 | ①中试剂 | ①中现象 | 解释 |
A | Ba(NO3)2溶液 | 生成白色沉淀 | SO32-与Ba2+生成白色BaSO3沉淀 |
B | 品红溶液 | 溶液褪色 | SO2具有漂白性 |
C | 紫色石蕊溶液 | 溶液变红 | SO2与水反应生成酸 |
D | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 |
A.AB.BC.CD.D