题目内容
【题目】在25 mL的碱式滴定管中盛有溶液,液面恰好在20 mL刻度处,现将滴定管内溶液全部放出,流入量筒内,所得溶液的体积为( )
A.5 mL
B.20 mL
C.大于5 mL
D.小于5 mL
【答案】D
【解析】本题考查滴定管的结构,滴定管的“0”刻度在上方,下方没有刻度的一段也充满溶液,所以当液面在20 mL刻度处时,滴定管内液体的体积大于5 mL。

【题目】实验室制乙酸乙酯得主要装置如图1所示,主要步骤①在a试管中按2:3:2的体积比配制浓硫酸、乙醇、乙酸的混合物;
②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;
③小火加热a试管中的混合液;
④等b试管中收集到约2mL产物时停止加热.撤下b试管并用力振荡,然后静置待其中液体分层;
⑤分离出纯净的乙酸乙酯.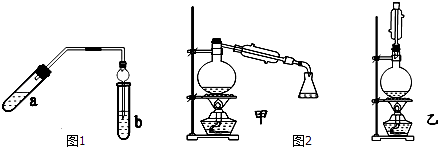
请回答下列问题:
(1)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式: .
(2)A装置中使用球形管除起到冷凝作用外,另一重要作用是 , 步骤⑤中分离乙酸乙酯必须使用的一种仪器是 .
(3)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图A所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管b再测有机层的厚度,实验记录如下:
实验编号 | 试管a中试剂 | 试管b中试剂 | 测得有机层的厚度/cm |
A | 3mL乙醇、2mL乙酸、1mL18molL﹣1 浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
B | 3mL乙醇、2mL乙酸 | 0.1 | |
C | 3mL乙醇、2mL乙酸、6mL 3molL﹣1 H2SO4 | 1.2 | |
D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是mL和molL﹣1 .
②分析实验(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.浓硫酸的吸水性能够提高乙酸乙酯产率的原因是 .
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是 .
④分离出乙酸乙酯层后,经过洗涤杂质;为了干燥乙酸乙酯可选用的干燥剂为(填字母) .
A.P2O5 B.无水Na2SO4 C.碱石灰 D.NaOH固体
⑤为充分利用反应物,该同学又设计了图2中甲、乙两个装置(利用乙装置时,待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物).你认为更合理的是 . 理由是: .
【题目】X、T、Y、Z为1﹣36号元素,且原子序数依次增大,四种元素的性质或结构信息如表.请根据信息回答下列问题.
元素 | T | X | Y | Z |
性质结构信息 | 原子核外s电子总数等于p电子总数;人体内含量最多的元素,且其单质是常见的助燃剂 | 单质为双原子分子,分子中含有3对共用电子对,常温下单质性质稳定,但其原子较活泼 | 第3周期元素的简单离子中半径最小 | 第4周期元素,M电子层为全充满状态,最外层只有一个电子的原子 |
(1)写出元素T的离子结构示意图;写出元素X的气态氢化物的电子式;X形成的单质分子,含个σ键,个π键.写出Z元素原子的外围电子排布式;元素Y的原子核外共有种形状不同的电子云.
(2)Y单质与氢氧化钠溶液反应的离子方程式: .
(3)元素T与氟元素相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是(填序号字母).
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目.