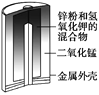
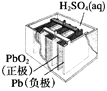
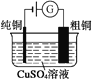
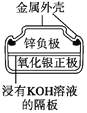
��Ŀ����
����Ŀ��ʳ�����ճ�����ı���Ʒ��Ҳ����Ҫ�Ļ���ԭ�ϡ���ʳ�γ���������Ca2+��Mg2+��Fe3+��SO42-���������ӣ�ʵ�����ᴿNaC1���������£�
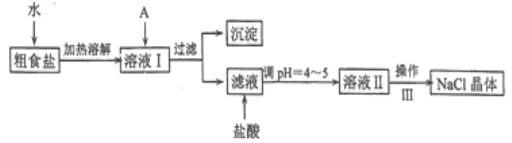
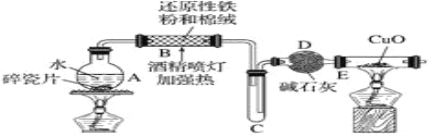
(1) ����A�Լ�����Ϊ�˳�ȥ��ҺI�е�Ca2+��Mg2+��Fe3+��SO42-���ӡ�A�������Ƕ����Լ������μ�˳������Ϊ:i��NaOH������_____������_______(�ѧʽ)��
(2) ��ͼ��ijѧ���Ĺ��˲���ʾ��ͼ��������淶����___________(����)��
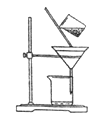
a.©��ĩ�˾���δ�����ձ���
b.��������������
c.����ֽʪ��ʹ�����©����
d.��ֽ��Ե�߳�©��
e.�ò�������©������������Լӿ�����ٶ�
(3) ����III��������___��
(4) mg�����ᴿ��õ�ng������NaCl���壬��m��n�Ĵ�С��ϵΪ__��
A.m>n B.m<n C.m=n D.��ȷ��.
(5) ʵ����������480 mL0.400mol/L���ᣬ������ͼ��ʾŨ�������ƣ��ش���������:
����
����ʽ: HCl
��Է�������: 36.5
�ܶ�: 1.2g/cm3
HCl����������Ϊ: 36.5%
����ȡŨ��������Ϊ:______mL��(�������1λС��)
���𰸡�BaCl2 Na2CO3 bc �����ᾧ D 16.7
��������
(1)����A�Լ�����Ϊ�˳�ȥ��ҺI�е�Ca2+��Mg2+��Fe3+��SO42���ӡ�Ҫ�����������Ҫ�Ȼ���������þ���ӡ���������Ҫ�������ơ�������������Ҫ̼���ƣ�����ʱ��Ҫ����ӹ��������ʣ���˹����ı�������Ҫ��̼���Ƴ��������̼����Ҫ�����Ȼ������档
(2)©��ĩ�˾���δ�����ձ��ڣ�����Ҫ�����ձ��ڣ���������������������Һ�彦����
����ֽʪ��ʹ�����©���ڣ���ֽ��Ե���ܸ߳�©�����ò�������©������ʱ�����ܽ����Լӿ�����ٶȡ�
(3)����III�Ǵ���Һ�еõ����壬����������������ᾧ��
(4)mg���β�����ж������ʣ������ٳ��ӹ�����Ҳ�������Ȼ��Ƶ�����������ᴿ��õ�ng������NaCl���壬��ȷ��m��n�Ĵ�С��ϵ��
(5)�����Ũ�����Ũ�ȣ��ٸ�����Һϡ�Ͷ��ɵõ���Ҫ��Ũ����������
(1)����A�Լ�����Ϊ�˳�ȥ��ҺI�е�Ca2+��Mg2+��Fe3+��SO42���ӡ�Ҫ�����������Ҫ�Ȼ���������þ���ӡ���������Ҫ�������ơ�������������Ҫ̼���ƣ�����ʱ��Ҫ����ӹ��������ʣ���˹����ı�������Ҫ��̼���Ƴ��������̼����Ҫ�����Ȼ������棬���Եμ�˳������Ϊ:i��NaOH������BaCl2������Na2CO3���ʴ�Ϊ��BaCl2��Na2CO3��
(2)aѡ�©��ĩ�˾���δ�����ձ��ڣ�����Ҫ�����ձ��ڣ���a���淶�����������⣻
bѡ���������������������Һ�彦������b�����淶���������⣻
cѡ�����ֽʪ��ʹ�����©���ڣ���c�����淶���������⣻
dѡ���ֽ��Ե���ܸ߳�©������d�������淶�����������⣻
eѡ��ò�������©������ʱ�����ܽ����Լӿ�����ٶȣ���e�������淶�����������⡣
������������Ϊbc��
(3)����III�Ǵ���Һ�еõ����壬����������������ᾧ���ʴ�Ϊ�������ᾧ��
(4)mg���β�����ж������ʣ������ٳ��ӹ�����Ҳ�������Ȼ��Ƶ�����������ᴿ��õ�ng������NaCl���壬��ȷ��m��n�Ĵ�С��ϵ����D��ȷ��
(5)�����Ũ�����Ũ��Ϊ![]() ���ٸ�����Һϡ�Ͷ��ɵõ���12molL-1V = 0.4 molL-1��0.5L�����V = 0.0167L = 16.7mL���ʴ�Ϊ��16.7��
���ٸ�����Һϡ�Ͷ��ɵõ���12molL-1V = 0.4 molL-1��0.5L�����V = 0.0167L = 16.7mL���ʴ�Ϊ��16.7��

 �����Ļ���������人������ϵ�д�
�����Ļ���������人������ϵ�д�