题目内容
【题目】下表中各粒子、粒子对应的立体构型及解释均正确的是( )
选项 | 粒子 | 立体构型 | 解释 |
A | 氨基负离子(NH2—) | 直线形 | N原子采用sp杂化 |
B | 二氧化硫(SO2) | V形 | S原子采用sp3杂化 |
C | 碳酸根离子(CO32—) | 三角锥形 | C原子采用sp3杂化 |
D | 碘三正离子(I3+) | V形 | I原子采用sp3杂化 |
A.AB.BC.CD.D
【答案】D
【解析】
A.NH2-中心原子N原子采用sp3杂化但N原子有两对价电子未参与成键,所以分子的立体构型为V型,选项A错误;
B.SO2中S原子的价层电子对个数=![]() 键数+孤对电子对数=2+(6-2×2)=3,含孤电子对数为1,杂化轨道数3,采取sp2杂化,结构为V形,选项B错误;
键数+孤对电子对数=2+(6-2×2)=3,含孤电子对数为1,杂化轨道数3,采取sp2杂化,结构为V形,选项B错误;
C.CO32-中,价层电子对数=3+(4+2-3×2)=3,含孤电子对数为0,杂化轨道数3,采取sp2杂化,分子形状为平面三角形;选项C错误;
D.碘三正离子(I3+)中I原子的价层电子对个数=![]() 键数+孤对电子对数=2+(7-1-2×1)=4,含孤电子对数为2,杂化轨道数4,采取sp3杂化,结构为V形,选项D正确;
键数+孤对电子对数=2+(7-1-2×1)=4,含孤电子对数为2,杂化轨道数4,采取sp3杂化,结构为V形,选项D正确;
答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】甲醇是一种重要的化工原料.

![]() 已知:
已知:![]()
![]()
写出表示甲醇燃烧热的热化学方程式 ______ .
![]() 甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.其反应为:
甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.其反应为:
![]()
![]()
![]()
![]() 该反应的平衡常数表达式为 ______ .
该反应的平衡常数表达式为 ______ .
![]() 下列措施中能使平衡时
下列措施中能使平衡时![]() 减小的是
减小的是![]() 双选
双选![]() ______ .
______ .
A.加入催化剂![]() 恒容充入
恒容充入![]() ,使体系压强增大
,使体系压强增大
C.将![]() 从体系中分离
从体系中分离![]() 恒容再充入
恒容再充入![]()
![]() 甲醇可以氧化成甲酸,在常温下用
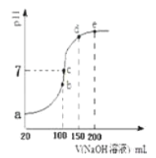
甲醇可以氧化成甲酸,在常温下用![]() NaOH溶液滴定
NaOH溶液滴定![]()
![]() 甲酸溶液过程中,当混合液的
甲酸溶液过程中,当混合液的![]() 时,所消耗的
时,所消耗的![]() ______
______
![]() 填“
填“![]() ”或“
”或“![]() ”或“
”或“![]() ”
”![]()
![]() .
.
![]() 利用甲醇燃烧设计为燃料电池,如图所示,则负极电极反应式为 ______ .
利用甲醇燃烧设计为燃料电池,如图所示,则负极电极反应式为 ______ .
![]() 合成甲醇的主要反应为:
合成甲醇的主要反应为:![]() 原料气的加工过程中常常混有一些
原料气的加工过程中常常混有一些![]() ,为了研究温度及
,为了研究温度及![]() 含量对该反应的影响,以
含量对该反应的影响,以![]() 、CO和
、CO和![]() 的混合气体为原料在一定条件下进行实验.实验数据见下表:
的混合气体为原料在一定条件下进行实验.实验数据见下表:
|
|
|
|
| ||||||||
反应温度 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 |
生成 |
|
|
|
|
|
|
|
|
|
|
|
|
由表中数据可得出多个结论.
结论一:在一定条件下,反应温度越高,生成![]() 的碳转化率 ______ .
的碳转化率 ______ .
结论二: ______ .