题目内容
【题目】铜的冶炼过程大致可分为:①富集,对硫化物矿进行浮选;②焙烧,主要反应为 (炉渣);③制粗铜,在1200℃下发生的主要反应为
(炉渣);③制粗铜,在1200℃下发生的主要反应为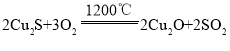 ,
, ;④电解精炼铜。下列说法不正确的是( )
;④电解精炼铜。下列说法不正确的是( )
A.上述焙烧过程的尾气回收后可用来制硫酸
B.上述过程中,由![]()
![]() 制取
制取![]()
![]() 共消耗
共消耗![]()
![]()
C.在反应 中,只有
中,只有![]() 作氧化剂
作氧化剂
D.电解精炼铜时,粗铜应与外接电源的正极相连
【答案】BC
【解析】
6molCuFeS2制取6molCu,说明铜元素全部变为Cu。
A.二氧化硫用在硫酸工业生产三氧化硫阶段,A正确;
B.6molCuFeS2制取6molCu,说明铜元素全部变为Cu。每个Cu从+2降低到0降低了2,每个S从-2价升高到+4升高了6,那么6molCuFeS2参与反应,铜元素得电子的物质的量=6mol×2=12mol,S元素失去电子的物质的量=6mol×2×6=72mol,所以6molCuFeS2总体失去(72mol-12mol)=60mol电子。O元素从0价降低到-2价,降低了2,1molO2得到电子物质的量=4mol,根据得失电子守恒可知,需要O2的物质的量=![]() =15mol,B错误;
=15mol,B错误;
C.Cu2S和Cu2O中的Cu化合价都降低到0价,所以反应![]() ↑中,Cu2S和Cu2O都作氧化剂,同时,Cu2S中S的化合价升高,Cu2S还作还原剂,C错误;
↑中,Cu2S和Cu2O都作氧化剂,同时,Cu2S中S的化合价升高,Cu2S还作还原剂,C错误;
D.电解精炼Cu时,粗铜溶解,故粗铜失电子,作阳极,D正确。
答案选BC。

练习册系列答案
相关题目