��Ŀ����
����Ũ�Ⱦ�Ϊ0.1 mol/L�����ֵ������Һ��A.Na2CO3��B.NaHCO3��C.NaAlO2��D.CH3COONa��E.NaOH��
(1)��������Һ��ˮ�ĵ���̶������� (����)��
(2)��������Һϡ����ͬ�ı���ʱ����pH�仯������ (����)��
(3)������A��B��C��D������Һ�������ʱ����һ����Һ����ܹ�������Ӧ��д���÷�Ӧ�����ӷ���ʽ�� ��
(4)��CO2ͨ��A��Һ��ǡ�ó����ԣ���Һ��2c(CO32-)+c(HCO3-)= mol/L (�跴Ӧǰ����Һ�������)��
(1)C (2)E (3)HCO3-+AlO2-+H2O=Al(OH)3��+CO32- (4)0.2
����

 ����νӽ̲���ĩ���Ԥϰ�人������ϵ�д�
����νӽ̲���ĩ���Ԥϰ�人������ϵ�д� ������ҵ��ٳɳ����½������������ϵ�д�
������ҵ��ٳɳ����½������������ϵ�д���ˮ�к��зḻ��þ��Դ��ijͬѧ����˴�ģ�⺣ˮ���Ʊ�MgO��ʵ�鷽����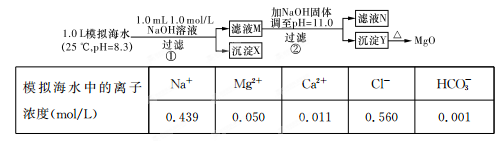
ע����Һ��ij�����ӵ�Ũ��С��1.0��10��5 mol/L������Ϊ�����Ӳ����ڣ�ʵ������У�������Һ������䡣��֪��KSp(CaCO3)=4.96��10��9��KSp(MgCO3)=6.82��10-6��KSp[Ca(OH)2]=4.68��10-6��KSp[Mg(OH)2]="5.61��10" -12��
����˵������ȷ����
| A��������XΪCaCO3 |
| B����ҺM�д���Mg2+��Ca2+ |
| C����ҺN�д���Mg2+��Ca2+ |
| D�������������Ϊ����4��2 g NaOH���壬������Yֻ��Mg(OH)2 |
���и���Һ�У�������ȷ����
| A��0.1mol��L��(NH4)2SO4��Һ�У�c(SO42��)��c(NH4��)��c(H��)��c(OH��) |
| B��25��ʱ����pH=3��������Һ��pH=11�İ�ˮ�������Ϻ���Һ������Ũ�ȵĴ�С��ϵ��c(Cl��)��c(NH4��)��c(OH��)��c(H��) |
| C����0.1mol/L������Һ�Ӵ���ˮϡ�ͺ���Һ��pH���� |
| D��Na2CO3��Һ�У�c(Na+ )="2c" (CO32- ) + c (HCO3- ) + c (H2CO3 ) |
�����£���1.000 mol��L-1�������20.00 mL 1.000 mol��L-1��ˮ�У���ҺpH���¶��������������仯������ͼ��ʾ�������й�˵����ȷ����( )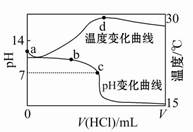
| A��a����ˮ�������c(H+)=1��10-14 mol/L |
| B��b�㣺c(NH4+)+c(NH3��H2O)=c(Cl-) |
| C��c�㣺c(Cl-)=c(NH4+) |
| D��d�����Һ�¶����½�����Ҫԭ����NH3��H2O�������� |
����pH��5��CH3COOH��Һ10 mL��Ҫʹ��pH����3���ɲ�ȡ�ķ�����( )
| A������Һ�м�ˮϡ����10 L |
| B������һ������NaOH���� |
| C������һ����pH��8��NaOH��Һ |
| D������һ��Ũ�ȵ����� |
0.1 mol��L-1��ˮ10 mL��������ˮϡ�͵�1 L�����б仯����ȷ����( )
�ٵ���̶�����c(NH3��H2O)����NH4+��Ŀ���ࣻ��c(OH-)���ݵ�������ǿ����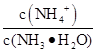 ����
����
| A���٢ڢ� | B���٢ۢ� | C���٢ۢ� | D���ڢܢ� |
�����£�0.1 mol��L��1 HX��Һ��pH��1��0.1 mol��L��1 CH3COOH��Һ��pH��2.9������˵������ȷ���� ����������
| A��HX��CH3COOH��������ˮ�ĵ��� |
| B��ȡHCl��HX��0.1 mol����ˮ���Ƴ�1 L�����Һ������Һ��c��H������0.2 mol��L��1 |
| C�������ʵ���Ũ�ȡ��������HX��Һ��CH3COONa��Һ��Ϻ����õ���Һ�У�c��Na������c��CH3COOH����c��CH3COO������c��H������c��OH���� |
| D��������ʵ���Ũ�ȡ��������HX��Һ��CH3COOH��Һ�У��ֱ����һ�����ʵ���Ũ�ȵ�NaOH��Һ����ʹ���ߵ�pH������7������������������Һ�������ǰ�ߴ��ں��� |
������,0.1 mol/L��ˮ��Һ��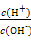 =1��10-8,������������ȷ����(�� ��)
=1��10-8,������������ȷ����(�� ��)
| A������Һ�������ӵ�Ũ��:c(H+)=1��10-11 mol/L |
B��0.1 mol/L��ˮ��Һ��0.1 mol/L HCl��Һ�������Ϻ�������Һ��:c(N )+c(H+)=c(Cl-)+c(OH-) )+c(H+)=c(Cl-)+c(OH-) |
C��0.1 mol/L�İ�ˮ��Һ��0.05 mol/L H2SO4��Һ�������Ϻ�������Һ��:c(N )+c(NH3)+c(NH3��H2O)=2c(S )+c(NH3)+c(NH3��H2O)=2c(S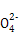 ) ) |
D��Ũ�Ⱦ�Ϊ0.1 mol/L��NH3��H2O��NH4Cl��Һ�������Ϻ�,����Һ�ʼ���,��c(N )��c(NH3��H2O)��c(Cl-)��c(OH-)��c(H+) )��c(NH3��H2O)��c(Cl-)��c(OH-)��c(H+) |