��Ŀ����
��7�֣���ij�¶��ºϳɰ���N2��3H22NH3����H<0������N2��H2��1�U1�����ʵ���֮�Ȼ��Ⱥ�ֳ����ȷݣ�ͬʱ�ֱ����A�����B�������װ�д�������������У�A��B�������ݻ��̶������ڱ���ͬ�¶��£�A��B���������ĺϳɰ���Ӧ�Ⱥ�ﵽƽ��״̬����ش�
��1��д���÷�Ӧ��ƽ�ⳣ������ʽ��_____________��KA______KB���>������<����=������
��2��ƽ�ⳣ��KֵԽ��������ƽ��ʱ__________��
A��N2��ת����Խ�� B��NH3�IJ���ԽС
C������Ӧ���е�Խ����
��3��������÷�ӦKֵ�����Բ�ȡ�Ĵ�ʩΪ__________��
A�������¶� B�������¶�
C������N2��H2��Ũ�� D��ʹ�ø�Ч�Ĵ���
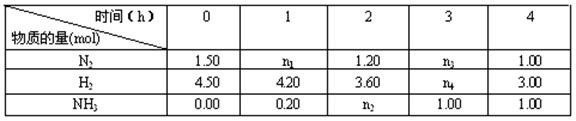
��4�������±������ݺ������������[M��ƽ����ʾƽ��ʱ������ƽ����Է�����������ƽ��ʱ������A��N2��ת����Ϊ___________������B��M��ƽ��Ϊ__________������______���A����B�����У�NH3�����ʵ�����ռ�ı����ϴ�
|
| ����A | ����B |
| M��ƽ�� | 20 |
|
| ƽ��ʱN2��ת���� |
| 10%[�� |
��7�֣���K��c2 ��NH3�� /[c��N2�� c3 ��H2��]��KA=KB����C����B����25%��16��7��A
����:

 �����Ծ���Ԫ���Ծ�ϵ�д�
�����Ծ���Ԫ���Ծ�ϵ�д� ��ѧ����Դ��������������ʮ�ֹؼ������ã�������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ�
��ѧ����Դ��������������ʮ�ֹؼ������ã�������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ� ��ѧ����Դ����������������ʮ�ֹؼ������ã�������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ�
��ѧ����Դ����������������ʮ�ֹؼ������ã�������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ�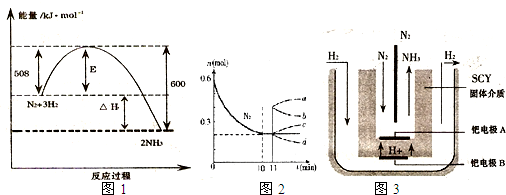
 2NH3 (g) ��H����92.2kJ��mol��1
2NH3 (g) ��H����92.2kJ��mol��1