题目内容
 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
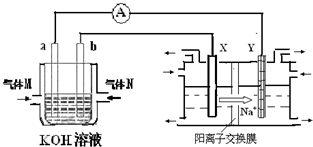
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.I.氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图实验(图中所用电极均为惰性电极):
(1)对于氢氧燃料电池中,下列表达不正确的是
CD
CD
A.a电极是负极,OH-移向负极
B.b电极的电极反应为:O2+2H2O+4e-=4OH-
C.电池总反应式为:2H2+O2
| ||
D.电解质溶液的pH保持不变
E.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)上图装置中盛有100mL、0.1mol?L-1AgNO3溶液,当氢氧燃料电池中消耗氢气112mL(标准状况下)时,则此时上图装置中溶液的pH=
1
1
(溶液体积变化忽略不计)II氢气是合成氨的重要原料.工业上合成氨的反应是:N2(g)+3H2(g)?2NH3(g)△H=-92.20kJ?mol-1.
(1)下列事实中,不能说明上述可逆反应已达到平衡的是
②③
②③
(填序号)①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成n mol N-H的同时生成n mol N≡N
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
④N2、H2、NH3的体积分数不再改变
⑤混合气体的平均摩尔质量不再改变
⑥混合气体的总物质的量不再改变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
时间(h) 物质的量(mol) |
0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | N2 | 1.00 | 1.00 |
①反应进行到2小时时放出的热量为
27.66kJ
27.66kJ
②此条件下该反应的化学平衡常数K=
| 4 |
| 27 |
| 4 |
| 27 |
③反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向
正反应
正反应
方向移动(填“正反应”或“逆反应”、“不移动”).分析:I.(1)氢氧燃料电池中,通入氢气的电极是负极,通入氧气的电极是正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,原电池放电时溶液中阴离子向负极移动,氢气和氧气反应生成水,导致溶液体积增大氢氧根离子浓度减小,pH发生变化,燃料电池不需要将氧化剂和还原剂储藏在电池内部;
(2)根据转移电子守恒结合电解池反应式计算生成硝酸的物质的量浓度,再根据pH的计算公式计算;
II(1)达到化学平衡状态时,正逆反应速率相等,各物质的浓度、质量、物质的量、百分含量不变,对于反应前后气体的化学计量数之和不相等的反应来说,达到平衡时,压强也不变;
(2)①根据氢气和反应热之间的关系计算;
②先计算平衡时各物质的浓度,再根据平衡常数公式计算;
③根据浓度商和平衡常数的相对大小判断,当浓度商小于平衡常数,则平衡向正反应方向移动,当浓度商大于平衡常数则平衡向逆反应方向移动,当浓度商等于平衡常数则达到平衡状态.
(2)根据转移电子守恒结合电解池反应式计算生成硝酸的物质的量浓度,再根据pH的计算公式计算;
II(1)达到化学平衡状态时,正逆反应速率相等,各物质的浓度、质量、物质的量、百分含量不变,对于反应前后气体的化学计量数之和不相等的反应来说,达到平衡时,压强也不变;
(2)①根据氢气和反应热之间的关系计算;
②先计算平衡时各物质的浓度,再根据平衡常数公式计算;
③根据浓度商和平衡常数的相对大小判断,当浓度商小于平衡常数,则平衡向正反应方向移动,当浓度商大于平衡常数则平衡向逆反应方向移动,当浓度商等于平衡常数则达到平衡状态.
解答:解:I.(1)A.燃料电池中通入燃料的电极是负极,所以a电极是负极,原电池放电时,电解质溶液中OH-移向负极,故正确;
B.通入氧气的电极是正极,正极上得电子发生还原反应,所以b电极的电极反应为:O2+2H2O+4e-=4OH-,故正确;
C.该原电池反应不需要点燃,其电池总反应式为:2H2+O2=2H2O,故错误;
D. 燃料电池放电时生成水,溶质的物质的量不变,但溶液的体积增大,所以电解质的物质的量浓度减小,则溶液的pH减小,故错误;
E.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置,(2)只需要不断补充氧化剂和还原剂即可,故正确;
故选CD;
(2)当氢氧燃料电池中消耗氢气112mL(标准状况下)时转移电子的物质的量=
×2=0.01mol,
电解硝酸银溶液的电池反应式为4AgNO3+2H2O=4Ag+4HNO3+O2↑,设硝酸的物质的量浓度为xmol/L,
4AgNO3+2H2O=4Ag+4HNO3+O2↑ 转移电子
4mol 4mol
0.1xmol 0.01mol
x=
=0.1,
所以硝酸的物质的量浓度是0.1mol/L,则溶液的pH=1,
故答案为:1;
II(1)该反应是一个反应前后气体体积减小的放热反应,
①当单位时间内生成2n mol NH3的同时生成3n mol H2时,说明反应v正=v逆,达到平衡状态,故不选;
②当单位时间内生成6n mol N-H的同时生成n mol N≡N时该反应才达到平衡状态,所以单位时间内生成n mol N-H的同时生成n mol N≡N时没有达到平衡状态,故选;
③无论反应是否达到平衡状态,同一时间段内用N2、H2、NH3的物质的量浓度变化表示的反应速率之比都为1:3:2,
所以不能判断是否达到平衡状态,故选;
④但反应达到平衡状态时,各物质的物质的量不再变化则N2、H2、NH3的体积分数不再改变,所以能说明达到平衡状态,故不选;
⑤根据质量守恒,反应前后混合物的质量不变,各物质的物质的量不再变化,其平均相对分子质量就不再改变,所以能说明达到平衡状态,故不选;
⑥但反应达到平衡状态时,各物质的物质的量不变,所以混合气体的总物质的量不再改变时说明达到平衡状态,故不选;
故选②③;
(2)①2小时时参加反应的氢气的物质的量=(4.50-3.60)mol=0.90mol,有3mol氢气参加反应时放出92.2kJ能量,
当0.90mol氢气参加反应时放出热量=
=27.66kJ,故答案为:27.66kJ;
②当反应进行到3小时时,生成氨气1.00mol,则参加反应的氢气的物质的量=
×3=1.50mol,n4=4.5mol-1.5mol=3.00mol,n3=1.50mol-
×1=1.00mol,3、4小时时各物质的物质的量不变,所以该反应在第三小时时已经达到平衡状态,平衡时c(NH3)=
=0.5mol/L,c(H2)=
mol/L=1.5mol/L,c(N2)=
mol/L
=0.5 mol/L,K=
=
,故答案为:
;
③反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,c(NH3)=1mol/L,c(H2)=2mol/L,c(N2)=1mol/L,
浓度商=
=
<K,则平衡向正反应方向移动,故答案为:正反应.
B.通入氧气的电极是正极,正极上得电子发生还原反应,所以b电极的电极反应为:O2+2H2O+4e-=4OH-,故正确;
C.该原电池反应不需要点燃,其电池总反应式为:2H2+O2=2H2O,故错误;
D. 燃料电池放电时生成水,溶质的物质的量不变,但溶液的体积增大,所以电解质的物质的量浓度减小,则溶液的pH减小,故错误;
E.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置,(2)只需要不断补充氧化剂和还原剂即可,故正确;
故选CD;
(2)当氢氧燃料电池中消耗氢气112mL(标准状况下)时转移电子的物质的量=
| 0.112L |
| 22.4L/mol |
电解硝酸银溶液的电池反应式为4AgNO3+2H2O=4Ag+4HNO3+O2↑,设硝酸的物质的量浓度为xmol/L,
4AgNO3+2H2O=4Ag+4HNO3+O2↑ 转移电子
4mol 4mol
0.1xmol 0.01mol
x=
| 0.01mol×4mol |
| 4mol×0.1mol |
所以硝酸的物质的量浓度是0.1mol/L,则溶液的pH=1,
故答案为:1;
II(1)该反应是一个反应前后气体体积减小的放热反应,
①当单位时间内生成2n mol NH3的同时生成3n mol H2时,说明反应v正=v逆,达到平衡状态,故不选;
②当单位时间内生成6n mol N-H的同时生成n mol N≡N时该反应才达到平衡状态,所以单位时间内生成n mol N-H的同时生成n mol N≡N时没有达到平衡状态,故选;
③无论反应是否达到平衡状态,同一时间段内用N2、H2、NH3的物质的量浓度变化表示的反应速率之比都为1:3:2,
所以不能判断是否达到平衡状态,故选;
④但反应达到平衡状态时,各物质的物质的量不再变化则N2、H2、NH3的体积分数不再改变,所以能说明达到平衡状态,故不选;
⑤根据质量守恒,反应前后混合物的质量不变,各物质的物质的量不再变化,其平均相对分子质量就不再改变,所以能说明达到平衡状态,故不选;
⑥但反应达到平衡状态时,各物质的物质的量不变,所以混合气体的总物质的量不再改变时说明达到平衡状态,故不选;
故选②③;
(2)①2小时时参加反应的氢气的物质的量=(4.50-3.60)mol=0.90mol,有3mol氢气参加反应时放出92.2kJ能量,
当0.90mol氢气参加反应时放出热量=
| 92.2kJ×0.90mol |
| 3mol |
②当反应进行到3小时时,生成氨气1.00mol,则参加反应的氢气的物质的量=
| 1.00mol |
| 2 |
| 1.00mol |
| 2 |
| 1.00mol |
| 2L |
| 3.00 |
| 2 |
| 1.00 |
| 2 |
=0.5 mol/L,K=
| (0.5)2 |
| 0.5×(1.5)3 |
| 4 |
| 27 |
| 4 |
| 27 |
③反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,c(NH3)=1mol/L,c(H2)=2mol/L,c(N2)=1mol/L,
浓度商=
| 1×1 |
| 1×23 |
| 1 |
| 8 |
点评:本题考查原电池原理和化学平衡移动等知识点,明确化学平衡状态的判断方法,知道有关化学平衡常数的计算,为高考的热点,应重点掌握.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
 化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.

 2NH3 (g) ΔH=-92.2kJ·mol-1
2NH3 (g) ΔH=-92.2kJ·mol-1