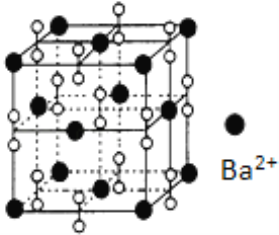
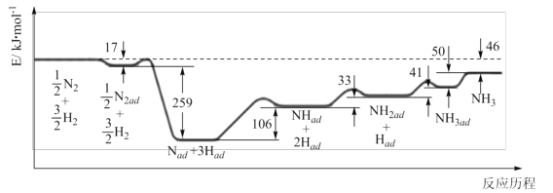
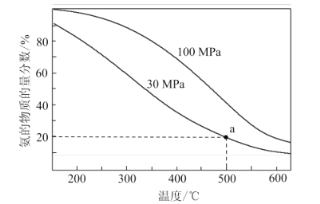
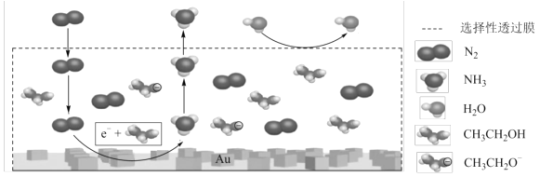
题目内容
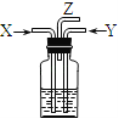
【题目】某研究性小组为探究铜丝与过量浓硫酸的反应,设计了如图所示装置进行有关实验,最后发现试管中铜有剩余。请回答:

(1)试管①中发生反应的化学方程式是 ________,该反应体现了浓硫酸的______(填“氧化性”或“还原性”)。
(2)试管②中的实验现象是______________。
(3)试管③中,NaOH的作用是____________。反应的化学方程式是______。
(4)该小组认为还应有一定的硫酸剩余,请说明铜丝未完全溶解并仍有一定量余酸的原因_______。
(5)为证明反应结束后的试管中确实有余酸,可选用下列药品中的______________ 。
A.锌粒 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(6)若想使铜继续反应可以向试管①中加入一种物质,该物质可能是_______(填序号)
A.NaNO3 B. Na2SO4 C. NaCl D.FeCl2
试写出该反应的离子方程式____________________________________________ 。
【答案】Cu+2H2SO4(浓)![]() CuSO4+2SO2↑+2H2O 氧化性 品红褪色 尾气处理,防止污染环境 SO2+2NaOH=Na2SO3+H2O 随着反应的进行,浓硫酸浓度变小,氧化性变弱,不再与铜反应 A D A 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
CuSO4+2SO2↑+2H2O 氧化性 品红褪色 尾气处理,防止污染环境 SO2+2NaOH=Na2SO3+H2O 随着反应的进行,浓硫酸浓度变小,氧化性变弱,不再与铜反应 A D A 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
【解析】
(1)铜和浓硫酸在加热条件下产生硫酸铜和二氧化硫和水;
(2)二氧化硫具有漂白性,能使品红褪色;
(3)二氧化硫气体有毒,需要用NaOH做尾气处理;
(4)有部分铜剩余,是因为硫酸在稀浓度时氧化性较弱,不能完全反应掉铜;
(5)可用活泼金属、碳酸盐来检验氢离子存在;
(6)铜可在常温下与稀硝酸发生氧化还原反应。
(1)试管①中是铜和浓硫酸的反应,反应的化学方程式是:Cu+2H2SO4(浓)![]() CuSO4+2SO2↑+2H2O;反应中S元素从+6价降低至+4价,化合价降低,体现了浓硫酸的氧化性,故答案为:Cu+2H2SO4(浓)
CuSO4+2SO2↑+2H2O;反应中S元素从+6价降低至+4价,化合价降低,体现了浓硫酸的氧化性,故答案为:Cu+2H2SO4(浓)![]() CuSO4+2SO2↑+2H2O;氧化性;
CuSO4+2SO2↑+2H2O;氧化性;
(2)二氧化硫能和品红溶液反应生成无色物质而具有漂白性,能使品红溶液褪色,试管②中的实验现象是:品红褪色;
(3) SO2是有毒气体,属于酸性气体,试管③中,NaOH的作用是:尾气处理,防止污染环境;反应的化学方程式是SO2+2NaOH=Na2SO3+H2O;故答案为:尾气处理,防止污染环境;SO2+2NaOH=Na2SO3+H2O;
(4)反应中浓硫酸被消耗,同时生成水,浓硫酸逐渐变稀,而Cu不能与稀硫酸反应,故有一定量的硫酸剩余,故答案为:随着反应的进行,浓硫酸浓度变小,氧化性变弱,不再与铜反应。
(5)A.剩余的硫酸能与锌反应生成氢气,有气泡出现,A正确;
B.氯化钡与硫酸、硫酸铜反应反应得到硫酸钡沉淀,不能用它来检验硫酸是否有剩余,B错误;
C.银不与稀硫酸反应,C错误;
D.剩余的硫酸Na2CO3溶液反应生成气体,可以检验硫酸是否有剩余,D正确;
故答案选:AD;
(6)溶液有剩余的硫酸,呈酸性,可加入NaNO3,硝酸根在酸性条件下具有强氧化性,能与铜在常温下反应,反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案:A;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。