题目内容
【题目】Weiss利用光敏剂QD制备2-环己基苯乙烯(c)的过程如图所示,下列有关说法正确
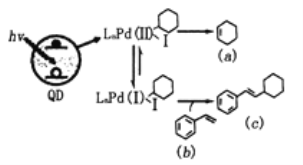
A.a中所有碳原子都在同一个平面上B.b既能发生氧化反应也能发生还原反应
C.b有共轭双键,能发生1,4-加成D.b、c是同系物
【答案】B
【解析】
A.a是环己烯(![]() ),1-4号位置的C都是sp3杂化,sp3杂化是四面体型,故所有碳原子不可能共平面,A错误;
),1-4号位置的C都是sp3杂化,sp3杂化是四面体型,故所有碳原子不可能共平面,A错误;
B.b是苯乙烯(![]() ),苯环及碳碳双键都可以催化加氢,发生还原反应;碳碳双键可以被KMnO4等强氧化剂氧化,发生氧化反应,B正确;
),苯环及碳碳双键都可以催化加氢,发生还原反应;碳碳双键可以被KMnO4等强氧化剂氧化,发生氧化反应,B正确;
C. 中有苯环,苯环中没有碳碳双键,故1-4号位置处不是共轭双键,C错误;
中有苯环,苯环中没有碳碳双键,故1-4号位置处不是共轭双键,C错误;
D.同系物是结构相似,分子式相差n个CH2的物质。c中有个六元环(![]() ),而b中没有,所以b、c结构不相似,不是同系物,D错误;
),而b中没有,所以b、c结构不相似,不是同系物,D错误;
故选B。

【题目】(1)氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如表中所示:
物质 | BN | AIN | GaN |
熔点/℃ | 3000 | 2200 | 1700 |
试从结构的角度分析它们熔点不同的原因___________________________________。
(2)N、P、As位于同一主族,基态氮原子的核外共有________种不同运动状态的电子,与PO43-互为等电子体的分子有________________(填一种即可)。
(3)铬原子的最高能层符号是_______,其价电子轨道表示式为____________________。
(4)比较第二电离能Cu_______Zn(填“>”、“=”、“<")。
(5)AuCl3是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态、还是气态,它都是以二聚体Au2Cl6的形式存在。写出Au2Cl6的结构式__________________________.
(6)已知Zn2+、Au+均能与CN-形成配离子, Zn2+与CN-形成的配离子为正四面体形,Au+与CN-形成的配离子为直线形. 工业上常用Au+和CN-形成的配离子与Zn单质反应来提取Au单质,写出该反应的离子方程式___________________________________________________________________________________ 。
【题目】化工原料水合肼(N2H4·H2O)是一种强还原性的碱性液体。
Ⅰ.实验室用下图装置制备水合肼(N2H4·H2O)。
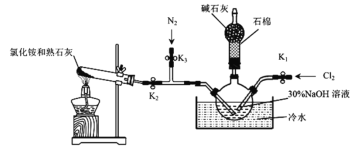
实验步骤:关闭K2、K3,打开K1,制备 NaClO;关闭K1、K2,打开K3,通入N2一段时间;关闭K3,打开K2,点燃酒精灯。回答下列问题:
(1)盛放碱石灰的仪器的名称为___________________。
(2)配制30%NaOH溶液时,所需玻璃仪器有烧杯、玻璃棒、胶头滴管和_________。
(3)步骤2中通入N2一段时间的原因是____________________________________。
(4)水槽中放入冷水的目的是_____________________________________________。
(5)NH3与 NaClO反应生成N2H4·H2O的化学方程式为_______________________。
Ⅱ.已知:N2H4·H2O+2I2=N2↑+4HI+H2O,测定水合肼粗产品的纯度步骤如下:
a.称取N2H4·H2O粗产品(其它杂质不与I2反应)2.000g。
b.加水配成250.00mL溶液。
c.移出25.00mL置于锥形瓶中,滴加几滴淀粉溶液。
d.用0.3000mol·L-1的碘标准溶液进行滴定。
e.重复上述操作两次。三次测定数据如下表:
实验序号 | 1 | 2 | 3 |
消耗碘标准溶体积/mL | 20.24 | 20.02 | 19.98 |
f.数据处理。
(6)碘标准溶液盛放在____________(填“酸式”或“碱式”)滴定管中。在滴定管中装入碘标准溶的前一步,应进行的操作为_________,达到终点的现象是__________。
(7)消耗的碘标准溶平均体积为______mL,粗产品中水合肼的质量分数为______。
(8)判断下列操作对测定结果的影响(填“偏高”、“偏低”或“无影响”)。
①若在配制碘标准溶液时,烧杯中的溶液有少量溅出,则测定结果___________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果___________。