题目内容
17.在铜锌原电池中,以硫酸铜为电解质溶液.锌为负极,失电子,电极上发生的是氧化反应(“氧化”或“还原”),电极反应式为Zn-2e-=Zn2+,铜为正极,得电子,电极上发生的是还原反应,电极反应式是Cu2++2e-=Cu,铜片上观察到的现象为有气泡生成_.分析 铜锌原电池中,较为活泼的金属锌为原电池的负极,发生氧化反应,正极为较不活泼的铜,发生还原反应,根据金属的性质和电解质溶液书写电极反应式.
解答 解:铜锌原电池中,较为活泼的金属锌为原电池的负极,失去电子发生氧化反应,电极反应式为Zn-2e-=Zn2+,正极为较不活泼的铜,发生还原反应,铜离子在正极上得电子生成铜,电极反应为,Cu2++2e-=Cu,同时有少量的氢离子在该极上放电,产生氢气,
故答案为:负;失;氧化;Zn-2e-=Zn2+;正;得;还原;Cu2++2e-=Cu,有气泡生成.
点评 本题考查原电池的工作原理,题目难度不大,注意正负极的判断和电极反应式的书写.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.下列关于化学反应进行方向的说法,错误的是( )
| A. | 熵是量度混乱(或无序)程度的物理量 | |
| B. | 液态水变为气态水、氯化铵溶于水、扑克牌洗牌等均属于熵增的过程 | |
| C. | 焓增或熵减的过程均不能自发进行 | |
| D. | 过程的自发性只能用于判断过程的方向,不能确定过程是否发生和过程发生的速率 |
5.下列除杂试剂错误的是( )
| A. | 除去溴苯中的溴单质用氢氧化钠溶液 | |
| B. | 除去硝基苯中的二氧化氮用氢氧化钠溶液 | |
| C. | 除去甲烷中的乙烯用酸性高锰酸钾溶液 | |
| D. | 除去苯中的苯酚用氢氧化钠溶液 |
9.把HI气体充入密闭容器中,在一定条件下发生反应:2HI(g)?H2(g)+I2(g),在反应达到平衡状态时,下列说法正确的是( )
| A. | HI的生成速率等于其分解速率 | |
| B. | HI的生成速率小于其分解速率 | |
| C. | HI的生成速率大于其分解速率 | |
| D. | 无法判断HI的生成速率和分解速率的相对大小 |
6.如图示意铁在氯气中燃烧的实验,铁丝点燃后,为维持燃烧继续,正确的操作是( ) 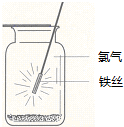

| A. | 铁丝应始终置于集气瓶瓶口位置 | |
| B. | 迅速将铁丝插入集气瓶接近瓶底位置 | |
| C. | 将铁丝从瓶口位置慢慢伸向瓶底位置 | |
| D. | 铁丝应不断上下移动 |
 .
.
 ,…O-O-O…链状排列中中间氧的价态为0.
,…O-O-O…链状排列中中间氧的价态为0.