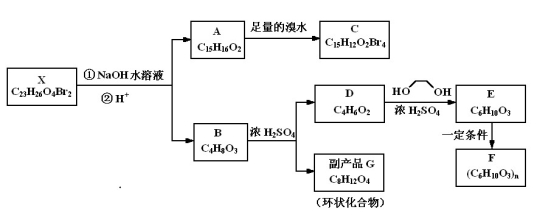
题目内容
【选修3物质结构与性质】(15分)
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化台物在研究和生产中有许多重要用途。请回答下列问题:
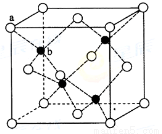
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是 ;

(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离
子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为 ;
(3)Se原子序数为 ,其核外M层电子的排布式为 ;
(4)H2Se的酸性比H2S (填“强”或“弱”)。气态SeO3分子的立体构型
为 ,SO32-离子的立体构型为 ;
(5)H2SeO3的K1和K2分别为2.7x l0-3和2.5x l0-8,H2SeO4第一步几乎完全电离,
K2为1.2X10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:
;
② H2SeO4比 H2SeO3酸性强的原因:
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm.密度为 (列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为 pm(列示表示)
(1)SP3
(2)O>S>Se
(3)34 3s23p63d10
(4)强 正四面体 平面三角形
(5)①H2SeO4和H2SeO3第一步电离产生的氢离子抑制第二步电离,所以第一步电离程度大于第二步电离程度。
②对同一种元素的含盐酸来说,该元素的化合价越高,其含氧酸的酸性越强。
(6)4.1 
【解析】(1)因为S8为环状立体结构,键角为120°,所以轨道杂化方式为SP3。
(2)根据同主族电离能变化规律,O、S、Se原子的第一电离能由大到小的顺序为O>S>Se.(3)Se原子序数为34,其核外M层电子的排布式为3s23p63d10(4)原子半径越大,氢化物越容易电离出氢离子,所以H2Se的酸性比H2S强。气态SeO3分子的立体构型为正四面体,SO32-离子的立体构型为平面三角形。(5)①H2SeO4和H2SeO3第一步电离产生的氢离子抑制第二步电离,所以第一步电离程度大于第二步电离程度。

【考点定位】原子的结构与性质、分子的结构与性质、晶体结构与性质、晶体的计算

(9分)
实验室制备1,2-二溴乙烷的反应原理如下:
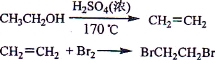
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:

有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | 一l30 | 9 | -1l6 |
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 ;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制各反应已经结束的最简单方法是 ;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用 洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用 的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 。
(17分)(2012?广东)苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原理:
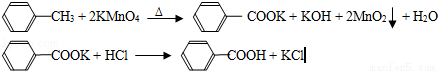
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.
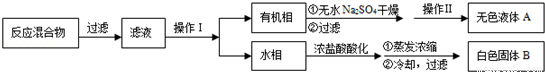
已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物都有固定熔点.
(1)操作Ⅰ为 ,操作Ⅱ为 .
(2)无色液体A是 ,定性检验A的试剂是 ,现象是
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容.
序号 | 实验方案 | 实验现象 | 结论 |
① | 将白色固体B加入水中,加热溶解, _________ _________ | 得到白色晶体和无色溶液 |
|
② | 取少量滤液于试管中, _________ | 生成白色沉淀 | 滤液含Cl﹣ |
③ | 干燥白色晶体, _________ | _________ | 白色晶体是苯甲酸 |
(4)纯度测定:称取1.220g产品,配成100ml甲醇溶液,移取25.00ml溶液,滴定,消耗KOH的物质的量为2.40×10﹣3mol,产品中苯甲酸质量分数的计算表达式为 ,计算结果为 (保留二位有效数字).