题目内容
18.下列有关Na2CO3溶液说法不正确的是( )| A. | 溶液呈碱性 | |
| B. | C(Na+)+C(H+)=C(OH-)+C(CO32-)+C(HCO3-) | |
| C. | 溶液中存在两个水解平衡关系:CO32-+H2O?HCO3-+OH-(主要)HCO3-+H2O?H2CO3+OH-(次要) | |
| D. | 溶液中离子浓度大小关系为:C(Na+)>C(CO32-)>C(OH-)>C(HCO3-)>C(H+) |
分析 碳酸钠溶液中,碳酸根离子在溶液中存在两个水解平衡关系:CO32-+H2O?HCO3-+OH-(主要)HCO3-+H2O?H2CO3+OH-(次要),溶液呈碱性,则c(OH-)>c(H+),氢氧根离子来自水的电离、碳酸根离子的两步水解,则c(OH-)>c(HCO3-),溶液中离子浓度大小为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);碳酸钠溶液中还存在电荷守恒:c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-),据此进行判断.
解答 解:A.碳酸根离子部分水解,溶液呈碱性,故A正确;
B.根据碳酸钠溶液中的电荷守恒可知::c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-),故B错误;
C.碳酸钠溶液中存在两个水解平衡关系:CO32-+H2O?HCO3-+OH-(主要)HCO3-+H2O?H2CO3+OH-(次要),且第一步水解程度远远大于第二步,故C正确;
D.碳酸钠溶液中,碳酸根离子部分水解,溶液呈碱性,则则c(OH-)>c(H+),氢氧根离子来自水的电离、碳酸根离子的两步水解,则c(OH-)>c(HCO3-),溶液中离子浓度大小为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故D正确;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,注意掌握盐的水解原理、电荷守恒、物料守恒的含义,明确判断溶液中离子浓度大小常用方法,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.下列说法中正确的是( )
| A. | 甲苯、二甲苯都属于苯的同系物,依据是这两种物质分子中均含有甲基 | |
| B. | 醇类的官能团是跟烃分子中饱和碳原子直接相连的羟基 | |
| C. | 醇类和酚类具有相同的官能团,因而具有相同的化学性质 | |
| D. | 甲醇、乙二醇、甘油都属于醇,依据是这三种物质分子中均含有饱和烃基 |
9.下列说法正确的是( )
| A. | 28g乙烯与30g乙烷中含有的极性共价键个数之比2:3 | |
| B. | 常温、常压下,22.4L C2H4气体完全加成需要lmolBr2 | |
| C. | C2H6和C4H10不一定是同系物 | |
| D. | 1molH2O2完全分解时转移电子2NA个 |
6.下列各组混合物,不能用分液漏斗分开的是( )
①四氯化碳、水 ②乙醇、甘油 ③乙醇、水 ④苯、水 ⑤已烷、水 ⑥环已烷、苯 ⑦溴苯、水.
①四氯化碳、水 ②乙醇、甘油 ③乙醇、水 ④苯、水 ⑤已烷、水 ⑥环已烷、苯 ⑦溴苯、水.
| A. | ②③⑥ | B. | ②④⑦ | C. | ①④⑤⑦ | D. | ③④⑥⑦ |
3.下列说法正确的是( )
| A. | 甲烷和乙醇均能发生取代反应 | |
| B. | 蛋白质、淀粉、油脂均能发生水解反应 | |
| C. | 溴乙烷与NaOH水溶液共热生成乙烯 | |
| D. | 油脂和淀粉都是高分子化合物 |
10.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 1.0mol/L 的Na2CO3溶液中:c(H+)+c(Na+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| B. | 1.0mol/LNH4Cl溶液:c(NH4+)=c(Cl-) | |
| C. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-) |
7.能在空气中稳定存在的是( )
| A. | H2S水溶液 | B. | Na2SO3晶体 | C. | 漂白粉 | D. | Na2SO4晶体 |
8.生活中的一些问题常涉及到化学知识,下列叙述正确的是( )
| A. | 苯、汽油、无水乙醇都是纯净物 | |
| B. | 甘油易溶于水,可用于制炸药TNT | |
| C. | 福尔马林和苯酚都是良好的杀菌剂,都可用于饮用水及环境消毒 | |
| D. | 室内装饰材料中缓慢释放出的甲醛、苯等有机物会污染空气 |
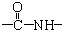 、一个
、一个 、一个
、一个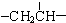 ,还有一个显碱性、一个显酸性的官能团.将该物质在一定条件下水解,能得到两种α-取代羧酸.其中一种的结构简式为:
,还有一个显碱性、一个显酸性的官能团.将该物质在一定条件下水解,能得到两种α-取代羧酸.其中一种的结构简式为: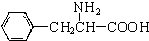 ,另一种水解产物结构简式为:CH3CH(NH2)COOH;
,另一种水解产物结构简式为:CH3CH(NH2)COOH;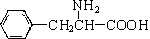 与CH3OH在一定条件下生成的酯是一种有用的合成中间体,利用该酯可与一种醇X发生取代反应,生成一种新的酯(
与CH3OH在一定条件下生成的酯是一种有用的合成中间体,利用该酯可与一种醇X发生取代反应,生成一种新的酯(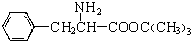 )和CH3OH,则醇X的结构简式为(CH3)3COH.
)和CH3OH,则醇X的结构简式为(CH3)3COH.