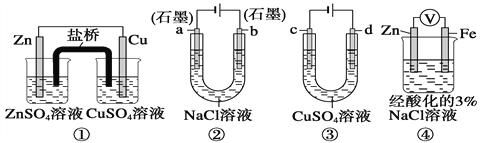
题目内容
【题目】下列溶液与20mL 1 molL—1 NaNO3溶液中NO3- 物质的量浓度相等的
A. 10 mL 1 molL-1 Mg(NO3)2溶液 B. 5 mL 1molL-1 Al(NO3)3溶液
C. 10 mL 0.5 molL-1 Ag NO3溶液 D. 10 mL 0.5molL-1 Cu(NO3)2溶液
【答案】D
【解析】根据硝酸钠的电离方程式NaNO3=Na++NO3-可知1 molL-1 NaNO3溶液中NO3- 物质的量浓度是1mol/L,则根据四种硝酸盐的化学式和电离方程式可知A~D选项中硝酸根离子的浓度分别是(mol/L)2、3、0.5、1,答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】下列实验能达到实验目的的是( )
实验目的 | 实验操作 | |
A | 比较S和Si的非金属性强弱 | 向Na2SiO3溶液中通入SO2产生白色沉淀 |
B | 除去NaHCO3溶液中的杂质Na2CO3 | 向混合液中通入足量的CO2气体 |
C | 检验某盐是否为铵盐 | 试样 |
D | 验证H2O2和Fe3+的氧化性 强弱 | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
A. A B. B C. C D. D
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2 (g) + H2 (g)![]() CO (g)+H2O (g),其化学平衡常数K和温度T的关系如下表:
CO (g)+H2O (g),其化学平衡常数K和温度T的关系如下表:
T/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(1)该反应的化学平衡常数表达式为K=________________________。
(2)该可逆反应的正反应为_____________反应(选填“吸热”或“放热”)。
(3)某温度下,各物质的平衡浓度满足关系式:3c(CO2)·c(H2) = 5c(CO)·c(H2O),该温度为______。
(4)若830℃时,该容器中的反应已达到化学平衡状态:
①在其他条件不变时,再向容器中充入2 mol CO2,达到新平衡后,与原平衡相比,H2的转化率_____(填“增大”“不变”或“减小”)。
②在其他条件不变时,再向容器中充入1 mol CO、2 mol H2O,达到新平衡后,其化学平衡常数K__1.0(选填“>”“<”或“=”)。
(5)若1200℃时,某个时刻,该密闭容器中的CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,此时上述反应________(填“正向” “逆向”或“处于平衡状态”)。
【题目】碱式碳酸镍[Nix(OH)y(CO3)z·nH2O]是一种绿色粉末晶体,常用作催化剂和陶瓷着色剂,300℃以上时分解生成3种氧化物。为确定其组成,某同学在实验室中进行了有关的实验探究。回答下列问题:
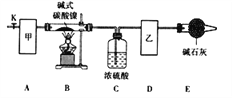
(l)甲、乙两装置可分别选取下列装置______、_______(填字母,装置可重复选取)。

(2)称取一定量的碱式碳酸镍样品,放入硬质玻璃管内;安装好实验仪器,检查装置气密性;加热硬质玻璃管,当装置C中________________(填实验现象)时,停止加热;打开活塞K,缓缓通入空气,其目的是______________________________。
(3)装置A的作用是________________________________________________,若没有装置E,则会使x/z__________(填写“偏大”或“偏小”或“无影响”)。
(4)实验前后测得下表所示数据:
装置B中样品质量/g | 装置C 质量/g | 装置D质量/g | |
实验前 | 3.77 | 132.00 | 41.00 |
实验后 | 2.25 | 133.08 | 41.44 |
已知碱式碳酸镍中Ni化合价为+2价,则该碱式碳酸镍分解的化学方程式为_______。
(5)采取上述实验装置进行该实验时,必须小心操作,且保证装置气密性良好,否则浓硫酸倒吸,可导致加热的硬质玻璃管炸裂。为防止浓硫酸倒吸入硬质玻璃管中,提出你的改进措施:______________________。