题目内容
【题目】以下是有关SO2、Cl2的性质实验。
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
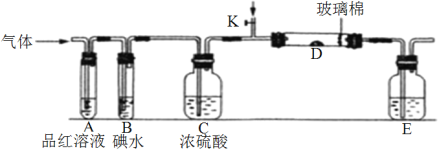
①若从左端分别通入SO2和Cl2,装置A中观察到的现象_________(填“相同或不相同”);若装置D中装的是V2O5(催化剂)。通入SO2时,打开K通入适量O2的化学反应方程式为__________________________________。
②SO2通入B中,溶液颜色褪去,则该反应的离子方程式为_______________________。
(2)某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量_________(填字母),能产生白色沉淀。
A.氨水 B.稀盐酸 C.硝酸钾溶液 D.氯化钠溶液
(3)若从左端通入Cl2,写出Cl2与装置E中溶液反应的离子方程式____________________。
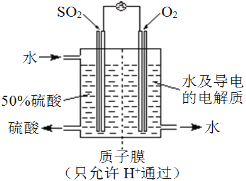
(4)某科研单位利用电化学原理用SO2来制备硫酸,装置如图。含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。通入SO2的电极为____极,其电极反应式为_____________________________;电池的总反应式为_______________________。
【答案】相同 2SO2+O2![]() 2SO3 SO2+I2+2H2O=4H++2I–+SO42– AC Cl2+2OH–=Cl–+ClO–+H2O 负 SO2-2e–+2H2O=SO42–+4H+ 2SO2+O2+2H2O=2H2SO4
2SO3 SO2+I2+2H2O=4H++2I–+SO42– AC Cl2+2OH–=Cl–+ClO–+H2O 负 SO2-2e–+2H2O=SO42–+4H+ 2SO2+O2+2H2O=2H2SO4
【解析】
根据物质的性质及实验原理分析实验现象并书写相关反应方程式;根据原电池原理及氧化还原原理判断正负极,书写离子方程式及电极反应式。
(1)①因为SO2和Cl2都可以使品红溶液褪色,所以装置A中观察到的现象相同;二氧化硫和氧气在催化剂作用下反应生成三氧化硫,方程式为:2SO2+O2![]() 2SO3;
2SO3;
② SO2具有还原性,可以还原碘水中的碘,反应的离子方程式为:SO2+I2+2H2O=4H++2I–+SO42–,
故答案为:相同;2SO2+O2![]() 2SO3;SO2+I2+2H2O=4H++2I–+SO42–;
2SO3;SO2+I2+2H2O=4H++2I–+SO42–;
(2)若加入的物质能和SO2反应生成硫酸或亚硫酸盐,则可以与氯化钡溶液反应产生白色沉淀,酸性溶液中硝酸根具有强氧化性,所以可以加入氨水和硝酸钾,
故答案为:AC;
(3)装置E为尾气处理装置,则离子方程式为:Cl2+2OH–=Cl–+ClO–+H2O,
故答案为:Cl2+2OH–=Cl–+ClO–+H2O;
(4)如图所示,二氧化硫反应后生成硫酸,硫元素化合价升高,失电子,作电池的负极;其电极反应式为SO2-2e–+2H2O=SO42–+4H+;总反应为二氧化硫、氧气和水反应生成硫酸,总反应式为2SO2+O2+2H2O=2H2SO4,
故答案为:负;SO2-2e–+2H2O=SO42–+4H+;2SO2+O2+2H2O=2H2SO4。


