题目内容
6.(1)比较原子半径的大小(填“>”或“<”,下同):O>F;K+>Ca2+.
(2)比较酸性强弱:H3PO4>H2SiO3
(3)稳定性:NH3> PH3.
分析 (1)同一周期内,原子半径随着原子序数增大而减小;电子层结构相同的离子,离子半径随着原子序数增大而减小;
(2)元素的非金属性越强,其最高价氧化物的水化物酸性越强;
(3)元素的非金属性越强,其氢化物的稳定性越强.
解答 解:(1)同一周期内,原子半径随着原子序数增大而减小,所以原子半径O>F;电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径K+>Ca2+,故答案为:>;>;
(2)元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性P>Si,所以酸性强弱:H3PO4>H2SiO3,故答案为:>;
(3)元素的非金属性越强,其氢化物的稳定性越强,非金属性N>P,所以氢化物的稳定性NH3>PH3,故答案为:>.
点评 本题考查元素周期律,侧重考查同一周期、同一主族性质递变规律,知道非金属性与其最高价氧化物的水化物酸性、氢化物稳定性的关系,题目难度不大.

练习册系列答案
相关题目
16.在一密闭容器中充入一定量的H2和N2,经测定反应开始后3s末H2的反应速率υ(H2)=0.3mol/(L•s),则3s末NH3的浓度为( )
| A. | 0.45 mol/L | B. | 0.6 mol/L | C. | 0.9 mol/L | D. | 1.2 mol/L |
17.11.2L甲烷、乙烷、甲醛组成的混合气体,完全燃烧后生成15.68LCO2(气体体积均在标准状况下测定),混合气体中乙烷的体积百分含量为( )
| A. | 20% | B. | 40% | C. | 60% | D. | 80% |
14.某一有机物A可发生如图变化:已知C为羧酸,且C、E不发生银镜反应,则A的可能结构有( )
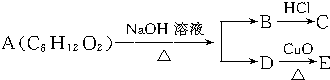
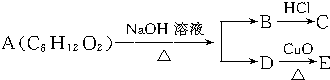
| A. | 4种 | B. | 3种 | C. | 2种 | D. | 1种 |
1.某无色气体X,可能含有CO2、SO2、HCl、HBr中的一种或几钟.将X通过适量的氯水时,X完全被吸收.将所得的无色溶液分装于两支试管后,分别加入酸化AgNO3与BaCl2溶液,结果均产生白色沉淀.下列推论正确的是( )
| A. | X中可能有HBr | B. | X中一定有SO2 | C. | X中可能有CO2 | D. | X中一定有HCl |
18.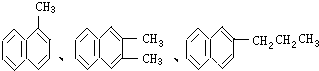 都属于萘的同系物.萘和萘的同系物分子组成通式是( )
都属于萘的同系物.萘和萘的同系物分子组成通式是( )
 都属于萘的同系物.萘和萘的同系物分子组成通式是( )
都属于萘的同系物.萘和萘的同系物分子组成通式是( )| A. | CnH2n-6(n≥11) | B. | CnH2n-8(n>10) | C. | CnH2n-10(n≥10) | D. | CnH2n-12(n≥10) |
15.与氨碱法比较,下列关于联合制碱法优点的判断中不正确的是( )
| A. | 提高了原料利用率 | B. | 降低了生产成本 | ||
| C. | 减少了环境污染 | D. | 减轻了对设备的腐蚀 |
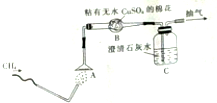 为了验证甲烷的燃烧产物,某同学设计了甲烷的燃烧实验(如图所示):
为了验证甲烷的燃烧产物,某同学设计了甲烷的燃烧实验(如图所示):