题目内容
【题目】如图中A~J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,已知B、D为常温下的气态化合物,C为常温下的液态化合物,F为黑色固体单质,I为红棕色气体。图中有部分生成物未标出。请填写以下空白: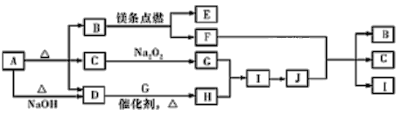
(1)A的化学式为___,C的电子式为___;
(2)写出下列反应的化学方程式:
D+G→H___;
F+J→B+C+I____;
(3)2molNa2O2与足量C反应转移电子的物质的量为___mol;
(4)I与足量C生成J的过程中氧化剂与还原剂的物质的量之比为___;
(5)容积为10mL的试管中充满I和G的混合气体,倒立于盛水的水槽中,水全部充满试管,则原混合气体中 I与G的体积之比为___。
【答案】NH4HCO3 ![]() 4NH3+5O2
4NH3+5O2![]() 4NO+6H2O C+4HNO3(浓)
4NO+6H2O C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O 2 1:2 4:1
CO2↑+4NO2↑+2H2O 2 1:2 4:1
【解析】
A受热能分解,分解得到等物质的量的B、C、D,且A与碱反应生成D,则A为酸式盐或铵盐,B、D为常温下的气态化合物,C为常温下的液态化合物,C能和过氧化钠反应,则C为水,镁条能在B中燃烧,则B为二氧化碳或氧气,因为A受热分解生成B、C、D,则B为二氧化碳,水和过氧化钠反应生成NaOH和O2,D能在催化剂条件下与G反应生成H,则D是NH3,G是O2,H是NO,I是NO2,J是HNO3,镁和二氧化碳反应生成氧化镁和碳,C和浓硝酸反应生成二氧化碳、二氧化氮和水,则E是MgO,F是C,通过以上分析知,A为NH4HCO3,以此解答该题。
(1) 、A为NH4HCO3,C为水,C的电子式为![]() ;
;
故答案为NH4HCO3;![]() ;
;
(2) 、D为NH3,G是O2,H是NO ,则D+G→H的反应为:4NH3+5O2![]() 4NO+6H2O;F是C,J是HNO3,则F+J- →B+C+I的反应为:C+4HNO3(浓)
4NO+6H2O;F是C,J是HNO3,则F+J- →B+C+I的反应为:C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
故答案为4NH3+5O2![]() 4NO+6H2O;C+4HNO3(浓)
4NO+6H2O;C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
(3)、Na2O2与足量水反应的方程式为:2Na2O2+2H2O=4NaOH+O2↑,氧由-1价升高为0价,由-1价降低为-2价,则2molNa2O2与足量C反应转移电子的物质的量为2mol,;
故答案为2;
(4)、由3NO2+ H2O=2HNO3+NO可知,氧化剂与还原剂的物质的量之比为1:2;
故答案为1:2;
(5)、容积为10mL的试管中充满NO2和O2的混合气体,倒立于盛水的水槽中,水全部充满试管,则发生的反应为4NO2+2H2O+O2=4HNO3,根据反应方程式可知原混合气体中NO2与O2体积比为4: 1,所以10mL混合气体中NO2和O2的体积分别为8mL和2mL,
故答案为4:1。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案