��Ŀ����
����Ŀ��ij�¶��£�H2��g��+CO2 ��g��H2O��g��+CO��g����ƽ�ⳣ��K= ![]() �����¶����ڼס��ҡ������������ܱ������У�Ͷ��H2 ��g����CO2 ��g��������ʼŨ�������ʾ�������жϲ���ȷ���ǣ�������
�����¶����ڼס��ҡ������������ܱ������У�Ͷ��H2 ��g����CO2 ��g��������ʼŨ�������ʾ�������жϲ���ȷ���ǣ�������
��ʼŨ�� | �� | �� | �� |
c��H2��/molL��1 | 0.010 | 0.020 | 0.020 |
c��CO2��/molL��1 | 0.010 | 0.010 | 0.020 |
A.ƽ��ʱ������CO2��ת���ʴ���60%
B.ƽ��ʱ�����кͱ���H2��ת���ʾ���60%
C.ƽ��ʱ������c��CO2���Ǽ��е�2������0.008 molL��1
D.��Ӧ��ʼʱ�����еķ�Ӧ������죬���еķ�Ӧ��������
���𰸡�D
�����������ڼ�������
H2��g��+ | CO2��g�� | H2O��g��+ | CO��g�� | |
��ʼ��mol/L�� | 0.01 | 0.01 | 0 | 0 |
ת����mol/L�� | x | x | x | x |
ƽ�⣨mol/L�� | 0.01-x | 0.01-x | x | x |
���� ![]() =
= ![]() �����x=0.006��
�����x=0.006��
A�������������֪���������ڶ�����̼��ת����Ϊ ![]() ��100%=60%�����º����£�������������ʼŨ�ȱȼ�����������ʼŨ�ȴ����ж�����̼��ת���ʱȼ��иߣ���ƽ��ʱ������CO2��ת���ʴ���60%����A���������⣻
��100%=60%�����º����£�������������ʼŨ�ȱȼ�����������ʼŨ�ȴ����ж�����̼��ת���ʱȼ��иߣ���ƽ��ʱ������CO2��ת���ʴ���60%����A���������⣻
B���ס�������������ʼŨ��n��H2����n��CO2��=1��1����ӦH2��g��+CO2��g��H2O��g��+CO��g��ǰ�������������䣬���º����£��ס���Ϊ��Чƽ�⣬ƽ��ʱ�ס�����H2��ת���ʾ���ȣ������������֪����������������ת����Ϊ ![]() ��100%=60%����B���������⣻
��100%=60%����B���������⣻
C�������������֪��ƽ��ʱ��������c��CO2��=��0.01��x ��mol/L=0.004mol/L���ס���Ϊ��Чƽ�⣬ƽ��ʱ���ס�����CO2��ת������ȣ���A�м����֪Ϊ60%����ƽ��ʱ��������c��CO2��=0.02mol/L����1��60%��=0.008mol/L������c��CO2���Ǽ��е�2������C���������⣻
D��Ũ��Խ��Ӧ����Խ�죬�ɱ������ݿ�֪���ס��������ڣ���ʼCO2Ũ����ȣ�����H2Ũ�ȱȼ���Ũ�ȴ����������ң��ף��ҡ��������ڣ���ʼH2Ũ����ȣ�����CO2Ũ�ȱ�����Ũ�ȴ��������ʱ����ң������ʱ����ң��ף���D�������⣬
���Դ��ǣ�D��
�����㾫����������Ĺؼ��������⻯ѧƽ��ļ�������֪ʶ�����շ�Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��ij�о���ѧϰС������ȷ�Ӧʵ��չ���о������и��л�ѧ�̲��ж������ȷ�Ӧ��������������������������Ӧ�ų��������ȣ�������ҫ�۵Ĺ�â������ֽ©�����²����մ���������������ɳ���������ġ���ѧ�ֲᡷ֪��Al��Al2O3��Fe��Fe2O3�۵㡢�е��������£�
���� | Al | Al2O3 | Fe | Fe2O3 |
�۵�/�� | 660 | 2054 | 1535 | 1462 |
�е�/�� | 2467 | 2980 | 2750 | -- |
������1��ijͬѧ�Ʋ⣬���ȷ�Ӧ���õ���������Ӧ�������Ͻ������ǣ��÷�Ӧ�ų�������ʹ���ۻ����������۵�����ͣ���ʱҺ̬���������ۺ��γ������Ͻ�����Ϊ���Ľ����Ƿ��������_____ ��������������������������
��2�����һ����ʵ�鷽����֤���������õĿ�״�������к��н���������ʵ�������Լ���_____ ����Ӧ�����ӷ���ʽΪ____ __��
��3��ʵ�����ܽ������������Լ�����õ���___ ___������ţ���
A��Ũ���� B��ϡ���� C��ϡ���� D������������Һ
����ʵ���о����֣����ᷢ��������ԭ��Ӧʱ�������Ũ��Խϡ����Ӧ��ԭ�����е�Ԫ�صĻ��ϼ�Խ�͡�ijͬѧȡһ������������������һ������ϡ�������ַ�Ӧ����Ӧ������������ų����ڷ�Ӧ���������Һ�У���μ���4molL-1������������Һ����������������Һ�������mL��������ij��������ʵ�����mol���Ĺ�ϵ��ͼ��ʾ���Իش��������⣺
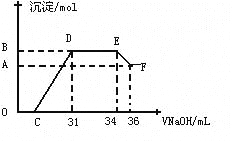
��4��ͼ��OC��û�г������ɣ��˽η�����Ӧ�����ӷ���ʽΪ____ __
��5����DE�Σ����������ʵ���û�б仯����˽η�����Ӧ�����ӷ���ʽΪ____ _ ����������˵����Һ��_____ _���OH����������___ ___ǿ�������ӷ��ţ���
��6��B���Ӧ�ij��������ʵ���Ϊ____ __mol��C���Ӧ������������Һ�����Ϊ____ __mL��


