题目内容
【题目】某同学设计实验如图所示:
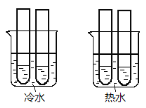
(1)两个烧杯中的试管都分别盛有2 mL 0.1mol/LH2C2O4溶液和4 mL 0.1 mol/L 酸性KMnO4溶液,分别混合并振荡,记录溶液褪色所需时间。该实验目的是研究____________,但该实验始终没有看到溶液褪色,推测原因________________。
(2)已知草酸(H2C2O4)受热分解的化学方程式为:H2C2O4 → H2O+CO↑+CO2↑,写出FeC2O4在密闭容器中高温分解的化学方程式____________________。
【答案】温度对反应速率的影响 KMnO4溶液过量 FeC2O4![]() Fe+2CO2↑(或FeC2O4
Fe+2CO2↑(或FeC2O4![]() FeO+CO↑+CO2↑、FeO+CO
FeO+CO↑+CO2↑、FeO+CO![]() Fe+CO2↑)
Fe+CO2↑)
【解析】
两烧杯中水的温度不同,该实验是研究温度对反应速率的影响;草酸与高锰酸钾反应的物质的量之比为5:2,结合草酸分解产生的物质分析反应方程式。
(1)两烧杯中水的温度不同,该实验是研究温度对反应速率的影响;草酸与高锰酸钾反应的化学方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,根据方程式可知二者物质的量之比n(H2C2O4):n(KMnO4)=5:2,试管中加入的H2C2O4的物质的量为n(H2C2O4)=c·V=0.1 mol/L×0.002 L=2.0×10-4 mol/L,KMnO4的物质的量n(KMnO4)=c·V=0.1 mol/L×0.004 L=4.0×10-4 mol/L,所以试管中草酸与高锰酸钾物质的量之比为1:2,高锰酸钾溶液过量,不能完全反应,所以溶液不褪色;
(2)FeC2O4在密闭容器中高温分解产生FeO、CO、CO2,反应的化学方程式为:FeC2O4![]() FeO+CO↑+CO2↑,分解产生的CO可能会还原FeO为Fe,继续发生反应FeO+CO
FeO+CO↑+CO2↑,分解产生的CO可能会还原FeO为Fe,继续发生反应FeO+CO![]() Fe+CO2↑,所以总反应方程式为FeC2O4
Fe+CO2↑,所以总反应方程式为FeC2O4![]() Fe+2CO2↑。
Fe+2CO2↑。

【题目】用如图装置进行实验;下列预期实验现象及相应结论均正确的是( )

a | b | 预期实验现象 | 结论 | |
A | 铜丝 | 浓硝酸 | 试管c中有大量红棕色气体 | 硝酸有强氧化性 |
B | 木条 | 18.4mol/L硫酸 | 木条变黑 | 浓硫酸有酸性及氧化性 |
C | 生铁 | NaCl溶液 | 导管处发生倒吸 | 生铁发生吸氧腐蚀 |
D | 铁丝 | 含少量HCl的H2O2溶液 | 试管c中有大量无色气体 | 该反应中铁作催化剂 |
A. A B. B C. C D. D