题目内容
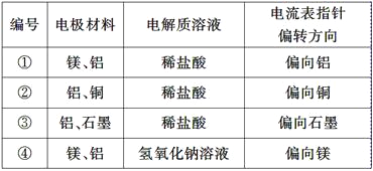
【题目】利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)![]() CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
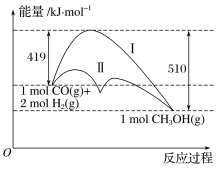
A.该反应的ΔH=+91kJ·mol-1
B.反应物的总键能小于生成物的总键能
C.加入催化剂,可以减小正反应的活化能,增大逆反应的活化能
D.如果该反应生成液态CH3OH,则ΔH增大
【答案】B
【解析】
A.反应前能量比反应后能量高,则该反应放热,![]() ,A项错误;
,A项错误;
B.该反应放热,则断裂旧键所吸收的能量小于形成新键所放出的能量,即生成物的键能大于反应物,B项正确;
C.(正)催化剂会同时减小正反应和逆反应的活化能,C项错误;
D.液化时要放热,因此生成液态甲醇会放出更多的热量,![]() 更低,D项错误;
更低,D项错误;
答案选B。

【题目】硫代硫酸钠(Na2S2O35H2O)俗名“大苏打”,又称为“海波”,易溶于水,难溶于乙醇,加热,遇酸均易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图所示,请回答下列问题。

实验具体操作:
Ⅰ.开启分液漏斗,使浓硫酸慢慢滴下,适当调节分液漏斗的滴速,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,至微沸。
Ⅱ.直至出现的浑浊不再消失,并控制溶液的pH接近7时,停止通SO2气体。
(1)仪器A的名称为______;B中多孔球泡的作用是______;装置C的作用是______。
(2)为了保证硫代硫酸钠的产量,装置B中溶液pH不能小于7,请用离子方程式解释原因______。
(3)为了尽可能得到较纯的Na2S2O3溶液,三颈烧瓶B中Na2S和Na2CO3的物质的量投料比应该为______。
(4)所得产品中常含有硫酸钠杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液等
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③______ | ④有乳黄色沉淀,______ |
⑤静置,取上层清液______ | ⑥______ |
(5)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水配制成100 mL溶液。
②滴定:取0.00950molL-1的K2Cr2O7标准溶液20.00mL,硫酸酸化后加入过量KI,发生反应:Cr2O72-+6I-+14H+═3I2+2Cr3++7H2O.然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32-═S4O62-+2I-.加入淀粉溶液作为指示剂,继续滴定,当溶液______,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为______%(保留1位小数)。
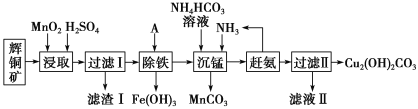
【题目】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有____(任写一种)。
(2)滤渣I中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的化学方程式:____。
(3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为____,若加 A 后溶液的 pH调为5,则溶液中 Fe3+的浓度为____mol/L。
(4)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:____。
(5)“赶氨”时,最适宜的操作方法是____。
(6)滤液Ⅱ经蒸发结晶得到的盐主要是____(写化学式)。
(7)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是____。