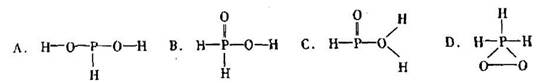题目内容
BF3与BCl3分子的空间构型均为平面正三角形,下列有关二者的比较中,正确的是
| A.分子中各原子最外层都满足8电子稳定结构 |
| B.键角均为60°,都是含有极性键的极性分子 |
| C.BF3沸点低于BCl3沸点,因为B-F键键长短 |
| D.BF3分子稳定性高于BCl3,因为B-F键键能高 |
D
试题分析:A、分子中的B原子最外层不满足8电子稳定结构,A不正确;B、BF3与BCl3分子中B原子均不含有孤对电子,所以都是平面三角形结构,键角均为60°,都是含有极性键的非极性分子,B不正确;C、二者形成的晶体类型都是分子晶体,BF3沸点低于BCl3沸点,是因为BF3的分子间作用力小于BCl3的分子间作用力,C不正确;D、F元素的非金属性强于氯元素的非金属性,所以B-F键键能高,因此BF3分子稳定性高于BCl3,D正确,答案选D。

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案
相关题目
 溶于水
溶于水
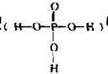 中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能跟D2O发生氢交换。由此可推断出H3PO2的分子结构是
中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能跟D2O发生氢交换。由此可推断出H3PO2的分子结构是