题目内容
(12分) 甲、乙、丙、丁四位同学在探究碱溶液与酚酞作用的实验时,发现了一个意外现象:氢氧化钠溶液滴入酚酞试液,溶液变成了红色,可是过了一会儿红色就消失了。
[猜想]
甲:可能是酚酞变质造成的;
乙:可能是氢氧化钠溶液与空气中的二氧化碳反应的缘故;
丙:可能是酚酞与空气中的氧气反应,使红色消失;
丁:可能与氢氧化钠溶液浓度大小有关。
[理论分析]
(1)甲同学刚提出自己的猜想,就遭到其余三位同学的否定,三位同学的理由是:
;
(2)丙同学认为乙同学的猜想也不正确,他的理由是
。
[实验设计]
(3)为证实丙同学的猜想,还需做如下实验,请完成下表:
(4)通过以上实验,四位同学观察到的现象是:溶液先变成红色,过了一会儿红色仍然消失。因此酚酞红色褪去与氧气无关。若丁同学的猜想正确,大家能设计实验证明吗?
[猜想]
甲:可能是酚酞变质造成的;
乙:可能是氢氧化钠溶液与空气中的二氧化碳反应的缘故;
丙:可能是酚酞与空气中的氧气反应,使红色消失;
丁:可能与氢氧化钠溶液浓度大小有关。
[理论分析]
(1)甲同学刚提出自己的猜想,就遭到其余三位同学的否定,三位同学的理由是:
;
(2)丙同学认为乙同学的猜想也不正确,他的理由是
。
[实验设计]
(3)为证实丙同学的猜想,还需做如下实验,请完成下表:
| 实验步骤 | 设计这一步骤的目的 |
| 1.将配制的氢氧化钠溶液加热 | |
| 2.在加热后的溶液中滴入酚酞,并在上方滴一些植物油 | |
| 实验方法 | 可能观察到的现象和结论 |
| 方案一:分别配制不同物质的量浓度的氢氧化钠溶液,然后各滴加数滴酚酞溶液。 | 物质的量浓度大的溶液中酚酞红色消失 证明 |
| 方案二:向原红色消失的溶液中加 (填试剂名称) | 红色重新出现,则说明红色消失与氢氧化钠物质的量浓度大小有关 |
⑴若酚酞变质,刚开始溶液就不会变红色了。
⑵氢氧化钠溶液与空气中的二氧化碳反应生成碳酸钠和水,碳酸钠水溶液显碱性,红色不会消失。
⑶①除去溶液的氧气 ②利用植物油隔绝空气
⑷①红色消失与氢氧化钠的物质的量浓度大小有关 ②水
⑵氢氧化钠溶液与空气中的二氧化碳反应生成碳酸钠和水,碳酸钠水溶液显碱性,红色不会消失。
⑶①除去溶液的氧气 ②利用植物油隔绝空气
⑷①红色消失与氢氧化钠的物质的量浓度大小有关 ②水
本题以实验探究为题材,考查学生的分析问题和解决问题的能力;(1)酚酞遇碱变红色,如果酚酞变质,则开始加入时就不能变成红色,故甲的说法不正确;(2)氢氧化钠与二氧化碳反应后生成碳酸钠溶液,碳酸钠溶液呈碱性,会使酚酞试液变红,故乙的说法也不正确;(3)丙同学先把氢氧化钠加热,是为了排净溶液中溶解的氧气,再加植物油是为了使试液与空气隔绝,防止发生氧化反应;(4)在丁同学的猜想中,如果在不同浓度的氢氧化钠溶液中,物质的量浓度大的溶液里酚酞的红色消失,则证明红色消失与氢氧化钠的物质的量浓度大小有关;若向红色消失的溶液中继续加水,红色重现,则证明其结论是正确的。

练习册系列答案
相关题目
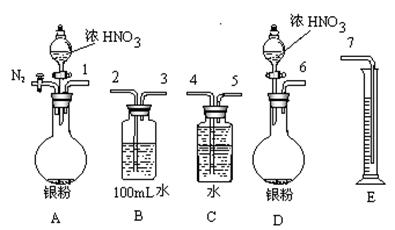
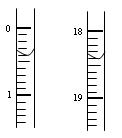
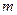 。
。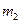 。
。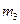 。
。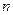 H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。
H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。